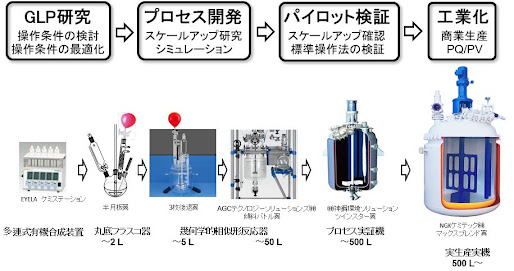
医薬品原薬のプロセス開発に於ける考え方とスケールアップ
証で得た経験と化学工学の専門家の助言等を得ながら理解し、新薬及び後発品原薬のプロ
セス開発から商業生産法を開発した経験を「プロセス開発及びスケールアップの考え方」
としてまとめたものです。
GLP研究から商業生産(例)
スケールアップとは、実験室のデータで最適化操作条件を基に製造現場の実機で大量に
合成することですが、実験室の装置内で起こっている現象・状態を製造実機で再現し原薬
の品質目標を達成させることです。従って、大小の装置内で生じている現象・状態を支配
している因子(ファクター)を定量的に一致させることが重要となります。これらの装置
内の現象・状態を決定する因子を一致させるためには、スケールアップシミュレーション
(実験機から製造実機)とスケールダウンシミュレーション(製造実機から実験機)でデ
ータ解析を実施することです。それぞれのシミュレーションを実施するためには、製造現
場の実機の原理・性能・能力を理解しておくことが大切です。実験室で最適化した操作条
件を実験機内の現象・状態をパイロットプラント或いは生産規模実機の原理・性能・能力
を基に再現するために化学工学的計算すること(スケールアップシミュレーション)。ま
た、パイロットプラント或いは生産規模実機の原理・性能・能力から実機をスケールダウ
ンして装置内の現象・状態を決定する因子を再現させたミニチュア(幾何学的相似形実験
機)機により最適化条件を検証すること(スケールダウンシミュレーション)。
では、何故、スケールアップで操作条件の再現が困難なのでしょうか。
実機で再現させることが困難であることは、プロセス開発で使用した装置・機器とスケ
ールアップ製造で使用する製造実機との間にはサイズ、幾何学的形状、原理、撹拌状態、
伝熱状態並びに操作時間などに差が生じるからと考えています。従って、製造スケールが
変われば槽内の現象・状態を相似させるために製造操作条件の因子を予測計算して見直
し、データ解析と検証が必要となります。
例えば、サイズの違う反応槽では、
1)製造スケール(容量)の違いから原料・試薬等の仕込み・濃縮・ろ過等の操作時間
が異なること
2)実験機と反応槽では、幾何学的形状が異なることから撹拌による反応槽内の溶液の流
れ(撹拌状態)に差が生じること、
3)プロセス開発(小スケール)で最適化した撹拌数を製造実機(大スケール)に適用し
ようとすると撹拌翼長が異なることから翼端の移動速度に差が生じ槽内の撹拌状態に
違いが生じること、
4)スケールアップ容量の倍率と反応槽のジャケット面積の増加倍率は一致しない。従っ
て、スケールアップすると「単位体積当たりの伝熱(ジャケット)面積」が小さくな
り加熱・冷却時間に差が生じること、等々が考えられる。
プロセス開発での異形実験機・パイロット機・実機の例
このことから、スケールアップするためには、幾つかの操作条件をスケールに合わせて
変更、濃縮液等の熱安定性の担保等が必要となる。また、実験機・パイロット機・実機の
変更、濃縮液等の熱安定性の担保等が必要となる。また、実験機・パイロット機・実機の
形状、撹拌翼・邪魔板等の形状が違えば槽内の流体の撹拌状態、伝熱状態が異なってく
る。プロセス開発では、製造スケールから使用予定の実機の幾何学的相似形(全ての寸法
を一定の割合で縮小した)反応槽を用いてスケールダウンシミュレーションを行い、得ら
れたデータ解析からスケールアップ前後での槽内の現象・状態を相似させるのに必要なス
ケールアップ因子を予測計算するスケールアップシミュレーションを実施することです。
スケールアップシミュレーション:
実験室で最適化した操作条件・槽内での現象と状態を製造スケールに合わせて化学工学
的予測計算し、スケールアップで使用する自社実機の構造・原理・能力・性能から発生が
予見されるトラブルを未然に解決し達成できるかを検証すること。実機の選択と達成でき
ない場合は新たに実機を設計・製作に必要なデータを得ることと考えています。
スケールダウンシミュレーション:
製造スケールに合わせて選択した実機の能力・性能値から化学工学的スケールダウン予
測計算値し幾何学的相似形実験機(反応器)を設計・製作し、作製した相似形実験機を用
いてその計算値範囲内で運転した時、実験室で最適化した操作条件・槽内の現象と状態の
相似が達成できるかを検証すことと考えています。
プロセス開発時と製造現場での設備・機器の違いから、
プロセス開発では、反応条件を含む工程内の全ての操作条件を最適化しますが、中間
体・原薬の品質を恒常的に保証する堅牢性のある操作条件を確定させる必要がある。プロ
セス開発で使用する実験室(或いは、パイロット製造現場)の設備・機器と製造現場の実
機の形状、サイズ、原理、撹拌状態並びに操作時間などの違いを理解せずデータ取りを行
いスケールアップするのか、理解してデータ取りするのか、或いは理解して原理が同じで
幾何学的相似形実験機でデータ取りを行うかにより操作条件の精度が異なってくる。スケ
ールアップ前には、スケールアップシュミレーションとしてスケールに合わせて予測した
操作時間・最適化した操作条件で原理が同じ幾何学的相似形実験機用いて操作条件を検証
することです。その結果から必要に応じてデータの取り直し、或いは操作条件の修正等を
行いながら操作条件を最適化することです。また、プロセス開発で得た操作条件・状態を
製造実機で忠実に再現するためには、最適化された操作条件の示量的数値(スケールに合
わせて変更すべき操作条件の数値)を見分け製造スケールに合わせて操作条件の設定値を
変更する必要がある。
一般的な実験室でのプロセス開発(操作条件の最適化)の実験操作例
では、どの様に操作条件を変更すれば良いのか、
今までは、スケールアップは勘と経験と度胸とよく言われてきましたが、プロセス開発
で最適化した工程操作条件(設定値)を製造実機で忠実に再現させるためには化学工学的
思考と計算が求められる。しかしながら、そのスケールアップの方法は各社のノウハウで
表に出せない、或いは専門家による資料が撹拌、伝熱、分離或いは乾燥等の単一操作につ
いての話のみで、プロセス開発から製造現場へのスケールアップの際に必要な工程操作全
体の一連の対処方法の纏まった資料・本・文献等が殆ど見当たりません。プロセス開発で
は原薬・中間体の品質・収率に最も影響を与える反応条件に目が行きがちですが、各製造
工程は原料・試薬・触媒・溶媒等の品質と仕込み操作から撹拌、加熱・冷却(伝熱)、反
応開始・反応・停止、抽出、濃縮、結晶化(晶析)、ろ過・単離、並びに乾燥操作等の組
み合わせで成り立っています。これらすべての操作条件が最適化されなければなりません
し、スケールが変わっても変更してはいけない条件(数値)は変更しないが、スケールア
ップに於いて変更すべき条件はプロセス開発時の状態を実機で再現するためにスケールに
合わせて変更しなければならない。
一般的な製造現場設備・機器と工程の操作例い
このことから、スケールアップに於いて変更しなければならない操作条件の数値(示量
的数値)と変更してはいけない数値(示強的数値)がある。撹拌状態を相似させるために
は、幾何学的相似形実験機を用いてスケールアップで使用する反応槽の容量比(容積率)
を合わせ撹拌数の最適値を求め、その撹拌数から予測計算して適用することです。
プロセス開発から製造現場での経験によって理解したスケールアップ時に重要なことは、
スケールアップで重要なことは数え上げればキリがないが、実験室(プロセス開発時)
で最適化条件をそのまま適用しても殆どの場合は品質に影響を与えることなく中間体及び
原薬を得られることが多々ある。これを当然と考えるか、偶然と考えるかで以後のプロセ
ス開発のやり方が異なってくる。実際、筆者もプロセス開発を始めた時は当然実験室で最
適化した操作条件をそのまま適用して良いと考えていました。それで殆どケースで問題な
くスケールアップ出来ていました。しかしながら、二相反応(水素添加反応)での撹拌に
よる失敗、濃縮時の熱安定性での失敗等を経験した。医薬品原薬の製造量程度では、バッ
チ式均一反応に於いて大きな影響を与えないかもしれませんが、失敗を最小限に留めるた
めにはプロセス開発で最適化した操作条件範囲のワーストケースでのデータ取りが重要と
なります。また、最適化された操作条件値はスケールを変更(スケールアップ或いはスケ
ールダウン)した場合に機能するかをシミュレーション(スケールに合わせた予測計算、
操作時間、熱安定性等々)により検証すべきです。
使用する主原料・溶媒等の品質の設定、反応条件の相似はもとより、
① 原料・試薬・触媒等の品質規格、仕込み方法、順番と条件(速度等)の設定
② 反応、抽出、晶析等の溶液濃度の相似
③ 各操作での撹拌状態の相似
④ 溶解状態の確認方法(特に、黒く粘性の高い中間体が飴状濃縮物で目視し難い場合)の設定
⑤ 反応条件である各操作温度・圧力の相似
⑥ 伝熱状態の相似
⑦ 各操作の設定温度への加熱・冷却(伝熱)及び維持に必要なジャケット内熱・冷媒温度の設定(特に低温反応に於いて)
⑧ スケールによる工程操作(仕込み、溶解、滴下、反応、抽出、濃縮、加熱・冷却、乾燥等)時間の違いの理解と操作時間+αの熱安定性担保
⑨ 工程操作原理の相似
➉ 濃縮状態の相似
⑪ 晶析時の粒子(サイズ)径の相似(特に、原薬の場合)
⑫ 乾燥状態(結晶水分・溶媒含量等)の相似
⑬ 原薬・中間体の品質目標としての品質規格の適合
⑭ その他の全ての操作を忠実に再現すること
⑮ ICHガイドライン:Q7(GMP)、
Q8(製剤開発、Quarity by Design)、Q9(品質リスクマネージメント)、Q10(製品品質保証システム), Q11(原薬の開発と製造)及びQ12(ライフサイクル管理等)の遵守
医薬品製造のプロセス開発で重要な操作条件の設定及びスケールアップ時の相似をあげ
てきたが、これらの操作の中で ①、②、③、⑤、⑥、⑦、⑧、⑨、⑪ 及び ⑬ は、プロセ
ス開発時に操作条件が最適化されていれば化学工学的思考で相似させることにより製造現
場で再現できると考えている。しかしながら、③ の撹拌状態、⑥ のジャケット内の熱・冷
媒温度、⑧ のスケールによる操作時間の違いと熱安定性担保、及び ⑪ の粒子径の相似は、
製造スケール、反応・晶析槽と撹拌翼の形状、冷却速度並びに撹拌状態の相似を達成させ
る必要がある。そのためには、プロセス開発時に最適化された操作条件をスケール、設備
の能力及び性能に合わせて変更しないと相似が達成出来ないからです。⑭ については、プ
ロセス開発から製造現場への操作条件・環境を理解し経験或いは操作条件に科学的根拠を
持ってマネージメントすることにより製造現場で忠実に達成できると考えています。⑮
ICHガイドラインの順守は、製造承認申請・MF(マスターファイル)申請に必須であり、
申請後の承認査察或いは当局からの質問で製造の標準操作法の操作条件・製造設備の選択
理由等の設定根拠が問われる。このことからもプロセス開発時のデータ取りは計画と工程
操作条件等の設定理由を明確にしておく必要がある。
③ の撹拌状態
撹拌状態を相似させるためには、プロセス開発時に製造現場反応槽と幾何学的相似形実
験機(反応槽の全ての寸法である槽径・高さ・形状、バッフルの形状・太さ、撹拌翼径・
形状及び太さ等が同じ、ミニチュア機)を用いて各操作に最適な撹拌数を設定します。設
定した撹拌数をスケールアップで使用する反応槽(幾何学的相似形実機)の撹拌翼径から
「単位体積当たりの撹拌動力(計算式 Pv = n X d2/3)一定」で予測計算します(n = 回転
数、d = 翼径(又は、D = 槽径))。この時ミニチュア機の仕込み容積率に合わせて実機の
仕込み量としてその計算撹拌数(n2)を適用させることにより、経験的にミニチュア機の
撹拌状態を実機で相似させることができると言われています。
撹拌のスケールアップ予測計算
Pv
一定
= 実験機:n1
X d12/3 = 製造実機:n2
X d22/3
製造実機予測計算撹拌数 = n2 = (n1 X d12/3) / d22/3
n1 : ミニチュア機の最適撹拌数、d1 : ミニチュア機の撹拌翼径、n2
: 実機の撹拌数、d2 : 実機の撹拌翼径
例えば、翼先端の円周長(距離) X 回転数 = 翼先端の溶液の時間当たりの移動距離とな
る。撹拌翼が回転するときの翼端は 2pr2 の距離を移動するが、経験上、大小の槽内の撹拌
状態を相似させるためには大小の槽内の容積率を同じにして撹拌翼の翼径長(2r = d)に
2/3 乗(d2/3)した長さを代表する距離として翼の回転数を掛けることで時間当たりの移動
距離を算出します。撹拌数のスケールアップは、この様にすれば相似できると理解してい
ます。その時間当たりの移動距離(速度)を同じにすることで大小の槽内の撹拌状態を相
似させられると言われています。
しかしながら、撹拌は一相系反応で撹拌状態が乱流域である限り(一般的には、目視で
良く撹拌出来ている時、この領域で撹拌しされています)実験機と実機の形状等が違って
も反応速度に殆ど影響を与えませんが、二相系反応(固-液、液-液等)では重大な影響を与
えることがあります。
どちらの実験機機が製造実機の撹拌状態を相似させ易いか
⑤ の反応条件である各操作温度・圧力の相似
操作温度は圧力等と同様に絶対に守らなければならない示強的数値である。
⑥ の伝熱の相似
スケールアップ後の反応槽とプロセス開発時の実験機の「単位体積当たりのジャケット
面積」が異なるため、同じ熱・冷媒温度を用いても加熱・冷却速度、反応温度を維持させ
る伝熱効果に差が出ます。下記に示す様に、幾何学的相似形実験機の集合体でスケールア
ップすれば伝熱面積に差が生じませんが、丸底フラスコ実験機では実機と形状が異なるた
め伝熱面積を評価するのが困難となります。ジャケット面積は反応槽の容量が10倍にス
ケールアップしても10倍になるのでなく 4.6 倍しか増加しません。従って、製造現場の
冷却能力が問題となりますので、冷却設備を共有するパイロット機で冷却データ(冷媒温
度)から実機の冷媒・熱媒温度を予測計算して冷却速度等の冷却状態を相似させることが
望ましいと考えています。特に、極低温反応では、発熱反応時の反応温度は冷媒温度を予
測計算して変更するか、冷媒の流速を上げる等の操作を加えないと維持できません。
どちらの実験機機が製造実機の伝熱(冷却)状態を相似させ易いか
極低温反応時の伝熱状態のステップワイズスケールアップ
⑧ の操作時間の違い違いと熱安定性
製造現場での工程の各操作時間はスケールと製造現場の設備・機器の性能・能力により
異なってきます。このことから、スケールアップ時の操作時間はプロセス開発時に各操作
で要した時間からのスケールに合わせて使用する製造実機の性能・能力を考慮して予測す
る必要があります。例えば、原薬・中間体等の熱安定性はその予測操作時間に安全率(安
全に、安定して操作できる時間を予測)を掛け担保する必要があります。
そのためには、原薬・中間体等の品質(純度、不純物量、不純物プロファイル等)、収
量が熱安定性等を担保した操作時間のワーストケースでトレース実験を実施して影響され
ないかの検証して置くべきです。スケールアップで操作時間の中で最も違いが生じるのは
濃縮時間ですが、スケールアップに於いてはスケールに合わせたその他の操作時間も予測
し時間の延長による品質への影響、原薬・中間体等の熱安定性を十分に担保して置くこと
を推奨します。
実験機とスケールアップ(製造実機)後の操作時間の違い(例)
スケールアップ後の操作時間は、製造スケール及び各社の製造設備・機器の性能・能力
の違いにより異なりますので、自社の実機の性能・能力を把握して換算表の様なものを作
成しておくことを推奨します。例えば、実機の濃縮能力:150 L/hr等。但し、濃縮時間等は
製造現場設備・機器の能力とスケールにより異なるので、自社の製造設備・機器の能力を
把握しておくことは大切です。
⑪ の粒子径の相似
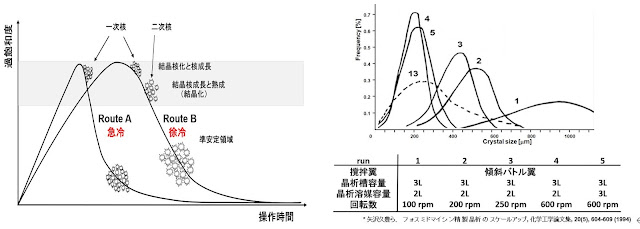
原薬の結晶サイズ(粒子径)は原薬の吸収・製剤化に重大な影響を与える。プロセス開
⑪ の粒子径の相似
原薬の結晶サイズ(粒子径)は原薬の吸収・製剤化に重大な影響を与える。プロセス開
発時に設定した晶析時の結晶粒子径を相似させるためには、冷却速度及び撹拌状態(速
度)を相似させることが重要と考えています。実際、下記に示す様に、晶析時の結晶のサ
イズは過飽和度(晶析溶液濃度)、冷却速度(A)と撹拌速度(B)でほぼ決まる。急な操
作を行うと一気に結晶化が進み成長せず小さな結晶を与える。スケールアップ前後で ②の
撹拌状態の相似及び ⑧冷却速度の相似を達成するためには、撹拌数の予測計算と冷媒流量
の変更(調整)が必要です。但し、バッチ晶析に於いては、内温調整が自動化されている
場合はプログラムの入力で、手動の場合は溶解温度から冷却させるので冷媒温度をあまり
気にせず冷却速度のみに注意しながらジャケット内の冷媒流量を調整することで達成させ
る。
A. 晶析にの冷却速度による結晶サイズ B. 撹拌数と結晶サイズ
C.
冷却速度
スケールアップ後の操作時間の予測、撹拌状態の相似並びに伝熱(冷却と加熱)の相似
について話しましたが、製造は一発勝負ですので事故・逸脱・品質の低下を避けるために
は操作範囲に熱安定性・安全性等の担保と操作目標値(最適値)を設定することが大切で
す。そのためには、スケールに合わせた操作予測時間以上の熱安定性、設定した操作パラ
メータの操作範囲外での品質を確保することです。工程操作のパラメータである操作範囲
は許容操作範囲に安全域の確保と必要であれば範囲に目標値(最適値)を設定されます。
製造はこの操作範囲及び目標値で製造標準操作法が作成され実施されます。この操作範囲
を設定するためには、操作範囲の上下の一定域を担保した許容範囲を確定させる必要があ
り、より幅広いデータ取りが必要となります。
工程操作条件の設定方法の考え方と例
工程操作条件の設定方法の考え方と例
操作範囲は実験室のミニチュア機(原理も同じ幾何学的相似形装置)を用いて予測操作
時間で最適化操作条件並びに設定操作条件範囲のワーストケースにより検証します。次
に、操作条件の示量的数値をスケールに合わせた予測計算値を求め、10~100倍程度のスケ
ールアップしたパイロット製造(50~100 L程度)によりデータ取りを行い予測値、品質等
を検証することです。
⑭ ICHガイドラインの順守
昔に、新薬メーカーの社長が1990年代後半に、「GMP を守って製造ができるか」と
⑭ ICHガイドラインの順守
昔に、新薬メーカーの社長が1990年代後半に、「GMP を守って製造ができるか」と
言った様な噂を聞いたことがある。製造現場は GMPを守って品質規格に適合した原薬を製
造し家族に安心して飲ませられる医薬品を作るため努力しているのにと腹立たしい思いを
したことがあった。ICHガイドラインを遵守しない医薬品を幾ら製造しても商品とはならな
いし、万が一市販後に投与された患者さんに副作用が出た、或いは承認申請内容と違う操
作を行った等が判明した場合は市中から回収・補償・操業停止等の命令が当局から発出さ
れる。ICH のガイドラインの遵守は製薬メーカー、原薬メーカー、製剤メーカー以外にも
保管倉庫業等に於いても必須条件であり、プロセス開発者であってもICHガイドライン(特
に、Q7~Q12)を理解し得おく必要がある。
次に、プロセス開発で最適化した操作条件・方法(製造標準操作法)はスケールアップに
耐えられますか?また、その根拠を取得していますか?
〇医薬品原薬のプロセス開発は、実機の能力・性能を理解して全ての反応・操作条件を組
〇医薬品原薬のプロセス開発は、実機の能力・性能を理解して全ての反応・操作条件を組
立ていますか?
〇合成ルート・標準製造法の問題点(スケールアップ因子)を抽出する品質リスクアセス
メント(工程操作条件、原理、操作時間、熱安定性等)を実施していますか?
〇出発原料(物質)、その他の原料、副原料、試薬及び触媒並びに重要中間体等の品質規
格は妥当ですか、また、出発物質等の供給体制に問題ないかを確認していますか?
〇実験室で設定した原料(出発原料等)と試薬・その他の原料・試薬・触媒等の量比は妥
当(最適)ですか、逸脱した場合の品質への影響を確認していますか?
〇設定した反応溶媒の種類と量は妥当ですか、危険性・安全性・残留溶媒等の品質と健康
への影響を確認していますか?
〇プロセス開発で最適化した操作(反応等)条件は、製造実機設備・機器の能力・性能を
〇プロセス開発で最適化した操作(反応等)条件は、製造実機設備・機器の能力・性能を
考慮して設定していますか(スケールアップシミュレーション)?
〇操作(反応等)条件を設定するプロセス開発時に、使用予定の製造実機の性能・能力を
反映・考慮した幾何学的相似形装置を用いてデータ取りをしていますか(スケールアッ
プシミュレーション)?
〇設定した反応温度並びに原料と副原料・試薬・触媒・溶媒等の量比に安全閾(許容範囲
-操作(設定)範囲)を設けていますか?
〇設定した操作パラメータの管理値は設定範囲或いは目標値*として管理していますか?反
応温度が設定範囲を外れた時、中間体或いは原薬への品質の影響を確認していますか?
〇実験室の操作条件は安全に操作でき、スケールアップに耐えられますか?
〇設定した反応温度(加熱・冷却)を現場機器でコントロールできますか?
〇反応を含めた工程操作はスケールと共に増大するが、中間体・原薬の熱安定性(温度X時
間)を確認していますか?
〇設定した反応条件は暴走しませんか(DSC・RC-1等により確認)?
〇工程反応の反応活性種の安定性・寿命並びに反応速度を評価していますか?
〇中間体及び原薬等が直接接触する製造設備(反応缶(GL, SUS、ハステロイ、樹脂製)、
ろ過装置等)の性能・能力・材質は操作条件に適格ですか?
〇工程操作条件はどこかの操作で安全に停止でますか、停止した時の保管条件と期間を検
証していますか?
〇設定した工程操作条件はスケールアップ(現場)を想定して設定し、検証実験(スケー
ルダウンシミュレーション)をしていますか?
(仕込み・滴下・投入・反応・後処理・濃縮時間、減圧度、乾燥温度・時間、不純物プ
ロファイル、晶析条件(冷却勾配等)、加熱・冷却勾配、熱安定性(温度・期間)等)
〇設定した撹拌及び加熱・冷却条件は妥当ですか? 現場製造設備の能力を反映させた撹
拌数及び加熱・冷却効率等を確認(予測計算等)していますか?
〇反応終点管理、工程内品質規格、製品品質規格並びに試験方法の妥当性を確認していま
すか?
〇その他原料・溶媒・試薬・副原料・触媒等の使用するすべての物質の調査・確認・検
証・対応を実施していますか(例えば、毒性、有害性、静電気・暴露管理等の安全性と
取扱い対策を取っているか?)?
スケールアップするためには、これらの項目を念頭に於いてデータ取り、解析、妥当性
の検証並びに製造標準操作法を核煮るすることである。取得したデータの信頼性確保(デ
ータ取りの実験計画、データ取り、データ解析と報告書などの品質マネージメントとして
GLPの遵守)とそれらの妥当性の検証と実証がスケールアップ、PVでの成功並びに医薬品
原薬のプロセス開発に於けるスケールアップに耐える製造標準操作法の確立、医薬品販売
承認申請並びに原薬のMF申請の手助けとなる。
* 範囲を設ける操作条件には、必ず目標値を設定すべきです。製造現場は手動でも±3℃で
操作できますが、目標値がなければ操作のし易い上限値或いは下限値で操作します。
以上の様に、医薬品原薬のプロセス開発に於ける製造現場へのスケールアップには多くの越えなければならない課題が山積しています。
スケールアップを成功させるためには、
・プロセス開発者は製造現場設備・機器の原理、能力・性能等の違いを理解すること
・プロセス開発時のデータ取り計画**の立案とデータ取り、得られたデータの解析と最適
化条件の範囲と操作目標値の設定すること
・スケールに合わせた操作時間の予測と安全域を考慮した熱安定性データの取得すること
・最適化操作条件(操作範囲と目標値)及び最適化製造操作法を設定すること
・操作原理が同じ幾何学的相似形機器(出来れば)を用いて最適化操作条件(操作時間は
予測時間+α**で、操作目標値と操作範囲のワーストケースで)及び最適化製造操作法に
よるスケールアップシミュレーションを実施すること
・製造予定(パイロット或いは実生産)のスケールアップスケールに合わせて示強的数値
を化学工学の予測計算式で計算し、スケールに合わせた最適化操作条件及び標準製造操
作法を修正すること
・次に、パイロット製造(~100 L)により、スケールに合わせた最適化操作条件及び標準
製造操作法が提要できるかを検証すること、パイロット製造時に予測計算値で運転しな
がら補正・修正を加えることがある。
・適用できない出来ない場合は、何故ズレが生じたのかの原因究明と検証を実施し、再デ
ータ取りと操作条件を再設定し直すこと、実生産規模へのスケールアップ時も同様に検
証と再設定を実施する。
・より精度の高い操作条件の設定値を求めるためには、実験機と製造(パイロット・商業
生産)実機の違いを理解(又は、究明)し、何故、何故を繰り返し、データ取り計画の
作成と実施、結果の考察と再予測計算の実施こと
・更に、パイロット製造或いは実生産規模(実際には、パイロット製造、治験量に合わせ
たスケール製造と実生産規模)製造でのスケールアップシミュレーションを繰り返し実
施し、それぞれのスケールにあった最適化操作条件及び標準製造操作法に仕上げる
プロセス開発者は実験室で操作条件の最適範囲と目標値並びに予測計算値をパイロット
或いはPQ(プロセスクオリフィケーション:商業生産規模)で検証し、製造バリデーショ
ン(商業生産)に向けたデータ取りにより、ズレの幅を最小化させる修正と検証を繰り返
し行い、全ての操作が PV(プロセスバリデーション:商業生産)に耐える操作条件にステ
ップワイズに仕上げることが必要です。
** 操作条件も同様な考え方でデータ取りを勧めます。この様な考え方でデータ取りをしてい
** 操作条件も同様な考え方でデータ取りを勧めます。この様な考え方でデータ取りをしてい
れば、製造時に異常が発生して標準製造法の操作範囲を少し逸脱しても、操作をストップ
しても熱安定性のデータがあれば品質への影響に対する説明根拠となる。例えば、プロセ
ス開発で最適化温度条件の上限と下限範囲を決めているが、筆者が今まで経験した殆どの
プロセス研究者は取得したデータの上限と下限値に安全域を取らずにそのまま操作範囲と
して設定している。上限値及び下限値のデータが1回であればたまたま問題なかったかも
しれない。データはバリデート(連続 3 回以上)されなければならない。
*** スケールに合わせた操作予測時間には、安全域(余裕)を持たせて熱安定性データ(出来
*** スケールに合わせた操作予測時間には、安全域(余裕)を持たせて熱安定性データ(出来
れば予測時間の1.5~2倍)を取得することをお勧めします。
最後に、プロセス開発に於けるスケールアップに必要な操作条件のデータ取り、その取扱いと安全域を確保して設定、撹拌、伝熱と操作時間の予測、熱安定性の取得、並びにスケールアップ因子等についてお話ししましたが、最適化した標準製造操作条件及び予測計算値を適用してもスケールアップでの成功は絶対ではありません。しかしながら、予測計算値、熱安定性データ、安全域を確保した操作条件と目標値等がなければ製造の設備・機器の性能・能力と経験と勘と度胸で試行錯誤し製造に対応しなければなりません。ながら実施すべきです。
最後に、プロセス開発に於けるスケールアップに必要な操作条件のデータ取り、その取扱いと安全域を確保して設定、撹拌、伝熱と操作時間の予測、熱安定性の取得、並びにスケールアップ因子等についてお話ししましたが、最適化した標準製造操作条件及び予測計算値を適用してもスケールアップでの成功は絶対ではありません。しかしながら、予測計算値、熱安定性データ、安全域を確保した操作条件と目標値等がなければ製造の設備・機器の性能・能力と経験と勘と度胸で試行錯誤し製造に対応しなければなりません。ながら実施すべきです。
プロセス研究者は、スケールアップ製造では必ず槽内の現象と状態及び異常の有無の確認、標準操作法の範囲内で操作ができるか等を慎重に見極め、品質目標を達成していても実施製造操作条件と品質の傾向の解析と検証を実施し、常に堅牢性と生産性が高い製造標準操作法へ仕上げて行く努力が必要である。










コメント
コメントを投稿