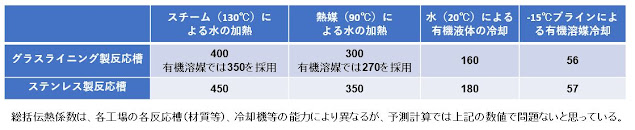
2) 乾燥の原理
乾燥原理は、外部から熱(気化熱)を加え湿晶に含まれる液体或いは固体から気体に変
化させることです。湿晶に付着した溶媒・水、或いは結晶中に含まれる水・溶媒(水和
物或いは溶媒和物)に熱を加え水・溶媒等の蒸気圧を高め気化量を増加させます。真空
或いは送風乾燥は減圧下で沸点を下げ気化量を増やし乾燥機内に発生する飽和蒸気を減
圧(真空)ポンプ或いは送風により新たに発生する飽和蒸気状態を連続的に系外(機
外)へ排出させます。
表 9. 溶媒の沸点と蒸気圧11)
水或いは溶媒の蒸気圧は、図 24に示す様に、一定温度で一定の値を取り、温度依存
的に高くなります。また、その気化熱を下げるためには、圧力を下げる(減圧下)こ
とです。例えば、水は20℃で蒸気圧は23.4 hPa(0.023 atm)、50℃では123.5 hPa
(0.122 atm)となり、蒸気圧は温度依存的に上昇し湿晶からより多くの溶媒(水)を蒸
気(気化)として奪います。
図24. 水・溶媒の蒸気圧曲線と減圧下での沸点換算図12)
3) 乾燥条件
低分子有機化合物中間体・原薬などの乾燥には、棚式送風・真空乾燥機、コニカル真空
乾燥機等が用いられることが多く、乾燥方法には送風、減圧、凍結、噴霧並びに不活性(調湿)ガス通気乾燥等の方法があります。それぞれの乾燥機は特徴を有しておりその選
択に際しては、実験室でその特徴を理解し使用予定実機を想定したデータ取りが重要で
す。乾燥条件として、低分子有機化合物は乾燥温度(化合物の熱安定性と時間により)
と、送風(常圧:温風温度と風量)か、真空(工場の真空ポンプの能力となる)かを決
定します。また、タンパク質或いはペプチド等の不安定で結晶化が困難な高分子化合物
は水溶液として凍結し減圧下で凍結乾燥行います。凍結乾燥では凍結温度と温度曲線を
決定することが重要です。
また、難溶性原薬の溶解性を改善するためにスプレードライヤー(噴霧乾燥機)を用い
て非晶質(アモルファス)固体分散体を得ることがあります。スプレードライ方法には
水系と溶媒系とがありますが、水系スプレードライ法は化合物の水溶液(有機溶媒の溶
液を用いることもあるが、静電気対策が必要)をノズル或いはディスクを用いて微細化
噴霧し熱風で乾燥する方法です。溶液の濃度、噴霧ノズルの形状(又は、ディスク)、
噴霧速度、乾燥温度並びに常圧か減圧下かなどの設定が必要と聞いています。不安定で
酸化され易い有機化合物、或いは原薬が水和物の場合は、加圧ろ過器を用いて湿晶をろ
過後、加熱不活性ガス通気して乾燥を行います。この時、通気ガス温度と流量
(m3/hr)並びに乾燥ガスか、加湿ガス(加湿するガスの温度と相対湿度)かを決定し
て実施します。
医薬品原薬(原薬)の湿晶乾燥条件を設定するためには、乾燥機器の原理だけでなく、
最終製品である原薬の結晶が無水物或いは水和物並びに結晶多形か、晶析・脱水後にど
の様な結晶状態(溶媒和物・水和物或いは無水物、結晶多形、結晶サイズ、ろ過性、
wet率等)で湿晶が得られるかを理解しておく必要があります。
リトドリン塩酸塩の乾燥条件の設定例*
リトドリン塩酸塩の湿晶は、メタノール‐アセトンからの晶析で得られるが、一種類の
減圧(真空)乾燥条件のみだけでは規格適合品の原薬(乾燥結晶)を与えなかった。こ
のことから、乾燥条件を種々検討し一次減圧乾燥後に乾燥温度を +20℃ 上昇させ短時
間の高温真空乾燥(二次乾燥)を追加することにより、品質の劣化がなく残留溶媒規格
適合品を得ることが出来た。この理由は不明であったが、一時乾燥温度では結晶内の溶
媒が結晶表面に染み出した時、結晶表面が溶解と結晶化が起こり蓋の役目を果たしそれ
以上溶媒が抜けず、二次乾燥による加熱により溶媒和物の結晶溶媒が外れたと考えてい
た。後に、この化合物は熱安定性の検討から +15~20℃ の温度条件下で最初から減圧
乾燥することにより二次乾燥操作なしに品質規格適合品を与えることが判明した。
また、小山ら13)は、湿晶エリスロマイシン誘導体の乾燥を60℃ で真空乾燥することに
より 7 時間で残留溶媒の規格適合品を得ているが、一次乾燥を 25℃ で真空乾燥後
に 60℃ に昇温し二次真空乾燥(トータル5時間)を実施することにより 60℃ の時よ
り約1時間速く残留溶媒規格適合品を与えることを示していまる。彼らは、真空乾燥で
得られた結晶を電子顕微鏡で結晶外観を観察し、コニカル真空乾燥で乾燥した原薬の結
晶表面は凹凸や間隙がなく、結晶表面が溶けているような状況が結晶表面を観察してい
る(図. 25)。この様に、乾燥条件は原薬の熱安定性・乾燥時間等の点かも重要ですの
で、化合物によっては最適化させる必要がある。
図 25. エリスロマイシン誘導体の乾燥条件による残留溶媒量13)
エリスロマイシンの通風乾燥と真空乾燥の結晶表面の電子顕微鏡写真
13) 小山ら、日本プロセス化学会2009ウインターシンポジウム
4) 乾燥操作で変化する湿晶
乾燥温度は、湿晶状態並びに乾燥状態の熱安定性(温度 X 時間)から決定することにな
条件である乾燥温度により結晶格子に入った溶媒が抜けポケットが空いた状態の結晶、
或いは空いた空間を埋めるために結晶中分子の立体構造変化或いは分子の滑り込み等が
生じた結晶構造を与えることがあります。これが疑似結晶多形の熱転移です。
図 26. 医薬品原薬カルバゾクロムスルホン酸ナトリウム水和物と無水物の結晶格子14)
以上の様に、乾燥操作のスケールアップには、所望の結晶形(無水物或いは水和物)を
得るための乾燥条件である乾燥温度と減圧(真空)度の設定だけでなく、湿晶の性質か
ら乾燥機の種類・原理を選択し、実験室、パイロット製造及び実生産で条件を忠実に再
現する必要があります。
5) 乾燥操作のスケールアップ
医薬品原薬の乾燥操作条件を設定するためには、晶析後にどの様な結晶状態(溶媒
和 物・水和物或いは無水物)で得られるか、製品である原薬がどの様な結晶形態(無水
物或いは水和物)・結晶多形であるかを理解しておくことをすでに話しましたが、スケ 式乾燥機、コニカル乾燥機及びろ過乾燥機が挙げられます。
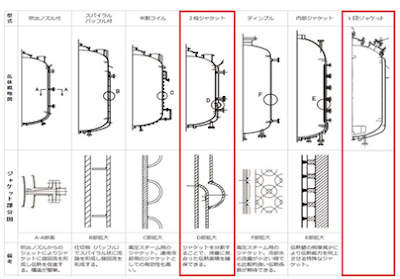
(1) 棚式乾燥機
棚式乾燥機には、送風及び真空乾燥機があります。その中で、棚式送風乾燥機はどの様
な状態の湿晶でもトレイに載せ、加熱した風を送りますので大量に処理できますが、時
間と熱安定性が問題となります。棚式真空乾燥は減圧下で棚板を温水で加熱し発生する
溶媒或いは水の蒸気をポンプで減圧とし連続的に外部へ排出させることからコンタミが
殆どなく中間体並びに原薬の乾燥に多用されます。乾燥温度設定は原薬等の安定性から
設定しますが、一般的に循環水の温度(循環水温度以上にならないために)を設定する
のが最も用いられている方法です。乾燥時間は乾燥温度及び工場の真空ポンプの能力と
乾燥機のシールド性による減圧度と排気量に依存します。
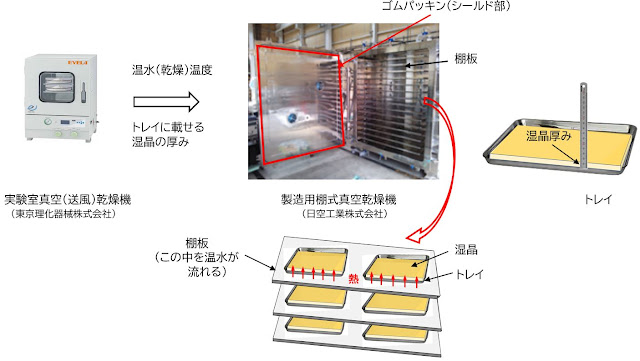
(1-1) 棚式真空乾燥機のスケールアップ
棚式真空乾燥機のスケールアップは、棚板から与える「単位体積当たりに与える熱量一
定」で実施するために「トレイに載せる湿晶の厚みをトレイ内及びトレイ間で一定」に
することです。このトレイへ入れる湿晶の厚みが棚式真空乾燥機のスケールアップで最
も重要な因子です。この厚みがトレイ内及びトレイ間で一定でないと湿晶容量当たりに
加わる熱量が一定にならず、棚板の熱源から湿晶に加えられる熱量に斑が生じ乾燥斑と
なることから乾燥時間に影響を与えます。但し、トレイの全体が棚板上に乗っているこ
と、乾燥機の棚板と湿晶が入ったトレイが密着していることが重要です。棚式真空乾燥
機の機器本体で重要なことは、棚板表面が波を打たずフラットであること、温水が均一
に通り均一に熱を伝える棚板の内部構造です。棚式真空乾燥機製作会社のノウハウは真
っ平らで均一に温水を流す棚板を作製する技術であると聞いています。下記に棚式真空
乾燥機の特徴を記載します。
棚式真空乾燥機の特徴を下記に示す。
a 真空下で低温乾燥するため、熱に弱い原料や酸化を嫌う中間体・原薬の乾燥に使用でき
る。
b 真空下で乾燥するため、原薬等の含水率をきわめて低く抑えることが出来る。
c 湿晶ばかりでなく、凍結水溶液等まで乾燥(凍結乾燥)にも用いられる。
d 静置乾燥のため、振動や摩擦に弱い原料の乾燥にも有効である。
e 温度コントロールは棚板に温水を流すたが容易であり、温度むらがほとんどない。
f 強酸物、金属を嫌う原料も、特殊材料や樹脂ライニングにより処理が可能です。
g 溶剤の回収が容易である。
h 減圧状態から常圧へ戻すときは、フィルターを通して、或いは不活性ガスを導入するの
で異物の混入(コンタミナーション)が非常に少ない。
従って、棚式真空乾燥機について述べましたが、目的化合物の熱安定性が確保出来ていれば細かい設定は必要なく、汎用性が高く、ほぼどの様な湿晶状態でも乾燥のスケールアップが可能です。しかしながら、棚式真空乾燥機にも欠点がある。それは、内部の洗浄と隅々の洗浄評価・確認が困難であること、湿晶をトレイに載せて静置乾燥するため結晶が微細でwet率の高い湿晶では途中で塊を解さないと硬い塊となること、また、均一性にも難があることが挙げられる。
図27. 棚式真空乾燥機のスケールアップ例
(1-2) 棚式送風乾燥機のスケールアップ
棚式送風乾燥機は、棚(金網或いはガイドのみ)に粉体を広げたトレイを載せ、その上
を熱風が通過させ湿晶を乾燥させる方式です。この乾燥機の特徴は、装置の大きさに対
して一度に処理できる量が多く、夜間運転させることも出来ます。このタイプの乾燥機
の場合、粉体上に流れる熱風の速度を粉体が飛散する限界までとなり、通常 2 m/s 程度
が限界と言われています。また、トレイに積む湿晶の厚みは 30 mm 程度で、厚くなる
と乾燥時間が長くなり乾燥斑が生じやすくなります。ガイドのみの棚式送風乾燥機は、
トレイを取り出してしまうと棚だけになるので内部の点検がし易いというメリットがあ
ります。しかしながら、外気を加熱して送風するためコンタミの危険性と比較的高温の
風が必要なこと、外気を送風するのでコンタミネーションが起こること並びに長時間を
要することから、殆ど安定な原料・初期の中間体にしか用いられないデメリットも持ち
合わせていいます。
図 28. 棚式乾燥機例
(2) コニカル真空乾燥機のスケールアップ
コニカル乾燥機は、真空状態でコニカル容器を回転させながら熱源となる温水をジャケ
ットに流し常に新しい湿晶面がジャケット面に直接接触させ乾燥させます。湿晶を大量
に処理でき、コニカル容器が回転するため均一性に優れた乾燥晶を与えます。乾燥機の
コニカル容器の材質としてステンレス、GL、樹脂ライニング等があり、材質を選べば酸
性物、酸性塩或いは塩基性物質(アルカリ性)の殆どの湿晶を乾燥することが出来る。
コニカル真空乾燥機の特徴を下記に記載します。
コニカル真空乾燥機の特徴
a 連続或いは間欠でコニカル容器の回転を制御でき、混合摩擦に弱い中間体・原薬
も形状を壊すことなく乾燥させることが出来る
b 密閉構造であり、真空にするためポンプで溶媒・水を蒸気として排出させることか
ら中間体・原薬汚染させない。
c 自動投入排出装置と定位置停止装置の採用により、全自動運転が可能である。
d 排気される溶媒蒸気をコールドトラップで捕集するため溶剤の回収が容易にでき
る。
e GLライニング以外に、樹脂ライニングや特殊材料のコニカル容器がある。
但し、コニカル真空乾燥機は、微細結晶でwet率が高い湿晶では大きな固い塊になること
があり、コニカルが回転するため GL製のコニカル容器の場合は内部表面のグラスを破
損させることがあります。乾燥条件は乾燥温度(ジャケットに流す温水温度)を湿晶及
び乾燥晶の熱安定性(温度 X時間)から、回転条件は、図 29に示す様に、実験室でエバ
ポレーターを用いて設定温度で回転数(rpm)、及び連続或いは間欠回転かを設定しま
す。この時、回転条件を変化させ湿晶の乾燥状況を確認しながら塊が出来ない回転方法
と回転数を最適化して設定します。
図29. コニカル乾燥機の実験室から製造現場(パイロット)へのスケールアップ例
富士フイルム和光純薬株式会社15)は、図 30に示す様に、ガラス製相似形のコニカルを用
いて連続回転或いは間欠(断続)回転により得られる乾燥晶の違いを示しています(参
考に)。
図 30. コニカル乾燥機の実験室での検討
(3) ろ過乾燥機のスケールアップ
ろ過乾燥機は晶析液のろ過、湿晶の洗浄と乾燥を一つの機器で実施できます。また、 撹
拌機付きでは湿晶・乾燥晶を撹拌できるため原薬の均一性に優れ、相対湿度で調湿した
不活性ガス(最適相対湿度)を流すことにより二次乾燥として水和物量の調整も 容易に
出来るのが特徴です。但し、大量には不向きであり、微細な結晶ではろ過及び 乾燥が困
難となることがあります。ろ過乾燥機のスケールアップは、第一にろ過性が 問題となる
ことから、実験室ではヌッチェろ過でろ過状態を確認して行うことを薦め ます。ろ過し
にくい結晶は、他の原理の乾燥機で一次乾燥を実施する、或いは晶析条 件を検討してろ
過性の良い結晶を得るかを判断することが必要です。
酸素、湿気に不安定な化合物の場合、不活性ガスを使用しながら遠心分離することが あ
りますが、一般的ではなくろ過乾燥機を用いることが多いです。また、ろ過乾燥機 は、
一次乾燥としてジャケットに温水、加熱乾燥不活性ガス通気により乾燥させ、二 次乾燥
(調湿乾燥)として所定温度と相対湿度を持った加湿不活性ガスを通気させ所 望の水和
物を作製するのに用いられます。
図 31. ろ過乾燥機(一次乾燥・二次乾燥)の実験室から製造現場(パイロット)への
スケールアップ例
(4) 調湿操作(二次乾燥)
原薬の幾らかの化合物は水和物として用いられています。湿晶が溶媒和物或いは水和物
で得られる場合があります。溶媒和物の場合は、一般的に一次乾燥で無水物として得
て、二次乾燥で調湿操作を行い目的とする水和物量の原薬を調製することが多くありま
す。湿晶が水和物の場合は、晶析条件と乾燥温度及び減圧度等を最適化して直接所望の
水和物量原薬を得るか、又は乾燥晶或いは湿晶に所定温度で相対湿度を調整した加湿不
活性ガスを通気させて所望の水和物量原薬を得ることがあります。以上の様に、原薬の
水和物量をコントロールする方法は幾つかありますので、原薬の性質にあった方法を選
択すべきです。
5. 原薬の乾燥事例
25年程前のことですが、筆者が経験した調湿操作は一次乾燥後に棚式真空乾燥機に 水の
入ったトレイを置き温度と時間を指定して減圧を掛け庫内に水蒸気を発生させ均 一に無
水物に水分を吸湿させていました。本化合物は一水和物が安定であったためこ の方法で
も問題ありませんでした。10年程前に、相対湿度で化合物の水和物量をコン トロール出
来ることを学ぶことが出来ました。不活性ガスの相対湿度、温度及び流量 を調整するこ
とにより有機化合物の水和物量を容易にコントロール出来ることも経験 しました。
1) セファレキシンの二次乾燥16)
例えば、植草ら16)によれば、セファレキシン(セフェム系抗生物質)は無水物が原薬で
すが、原薬に湿度と温度条件(温度は不明)により無水物(R.H.=相対湿度 0%)から
2.5水和物(R.H. 100%)の5段階の水和物を与えることが示しています。
図32. セファレキシンの水蒸気吸着測定
2) スタチン類縁体カルシウム水和物の二次乾燥(水和物の調湿)事例12)
スタチン類縁体の原薬は、3 水和物(局方規格水分値
3.5~5.5%)であり、二次乾燥
(調湿操作)で相対温度を調整した加湿窒素で結晶表面上を通過させることにより所 望
の水分量を吸収させることを考えました。化合物は自身の物性として水和物量を相 対湿
度に合わせて結晶中の水分を吐いたり吸ったりして所望の結晶水量(1 水和物或 いはそ
れ以上の水和物)を与えることが知られています。
図 33. スタチン類縁体カルシウム水和物の構造と二次乾燥用機器
スタチン類縁体カルシウム水和物の二次乾燥(調湿操作)は、SVミキサーを使用するこ
とを予定していた。実験室では、製造で調湿(二次乾燥)操作に用いるSVミキサーと幾
何学的相似形ではないが常に結晶の新しい表面を作るために撹拌翼付き晶析槽 のミニチ
ュア機を用いて実施した。パイロット製造では100 LのSVミキサーを、バリ デーション
(商業生産)では3,000 L SVミキサーを用い実施することを予定していた。
図34. 二次乾燥の実験室からパイロットへのスケールアップ例
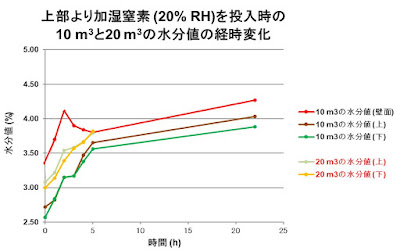
二次乾燥の調湿操作(水和物の調製)は、得られた一次乾燥(40℃、減圧乾燥)後に水
分値約2.0%を水分値 3.5~5.5 %へ調整する操作です。加湿条件は、幾何学的相似形で
はないが晶析ミニチュア機を用いて撹拌下、温度 20℃ から 40℃ で、相対湿度約10%
及び 20% の加湿窒素、流量10 m3/hr及び20 m3/hrで通気させデータ取りを実施した。そ
の結果、温度40℃、相対湿度20%、流量10 m3/hr及び20 m3/hrで通気させた時、5.0 時間
で目標の水分値内 (3.5~5.5%)に到達した。更に、22.0 時間まで二次乾燥を行なった
が、二次乾燥開始5.0 時間後からほぼ横ばいとなった(図35)。この時、スタチン類縁体水
和物は加湿操作で凝集・溶解等の不具合を示さなかった。
図 35. 加湿窒素(20%RH)供給時の流量による結晶水分値*
また、相対湿度を制御して調湿(40℃、相対湿度20%、流量10 m3/hr)を行うと、規格
水分値を超えたスタチン類縁体(水分値 5.7%)は相対湿度に合わせて結晶の持つ物性に
従い水を吐いたり吸ったりして制御します(図36)。
図 36. 相対湿度制御時のスタチン類縁体の水分値の推移*
次に、パイロット(商業生産量の1/10スケール)での二次乾燥は、加湿窒素 40℃、
25% RH、流量 10 m3/hr で実験通りに問題なく進行し、4時間後に目標水分値 4.5~5.0
(局方:3.5~5.5%)に収まった。また、外観からは、凝集・塊等は認められなかった。
この結果を受け、図33に示す様に、スケールアップバリデーションを実施した。スケー
ルアップバリデーションは、下記に示した二次乾燥時間の計算を基に、3,000 L SVミキ
サーを用いてパイロット時と同条件下で調湿を加湿窒素 40℃、相対湿度 25%、流量
10 m3 /hrで実施した。最終製品である医薬品原薬はパイロットスケールと同様に品質の
低下等もなく品質規格適合の水和物原薬が得られ達成された。
図 37. 二次乾燥のパイロット製造から商業生産へのスケールアップ
6. 粉砕機の選定とスケールアップ
1) 粉砕機の選択とスケールアップ
医薬品原薬で用いられる代表的な粉砕機には、以下に示す様な原理の異なる装置があ
る。粉砕操作で大切なことは結晶の粒子サイズ(平均粒子径(及び粒度分布を揃える、
結晶の多形転移(圧転移)を起こさせない、摩擦熱等で溶融及び結晶多形転移(熱転
移)を起こさせないことです。
粉砕に関する多くの研究が行われているが、粉砕の操作条件と粉砕の結果(平均粒子
径、粒度分布)を結びつけるような方法はまだ得られていないのが現状であると聞いて
います。このことから、粉砕のスケールアップはパイロットで使用した粉砕機を用い製
造量に合わせて数回に分け実施するのが一般的です。
最近の低分子治験薬は複雑な構造を取るものが多く、新薬メーカーの多くが難溶性で体
内吸収しづらい悩みを抱えている。医薬品原薬は粒子径が微粉末になるにつれ溶解速度
が上昇し体内吸収が改善されることから、難溶性原薬の粉砕に第一選択しとしてジェッ
トミルを指定している。粉砕機の原理の違い(種類)により粒子径をある程度制御でき
ることから、粉砕機の選択と平均粒子径・粒度分布を制御する粉砕操作は今後ますます
重要となると考えている。
図 38. 粉砕機の種類と平均粒子径18)
粒度に関して覚えておくべき名称
・ 平均径:母集団の「平均」粒径です。
・ メディアン径(中央径;D50):粉体を粒径から2 つに分けたとき、大きい粒径と
小さい粒径が50% ずつとなる径です。
・モード径(最頻径):最も高い頻度の粒径です。
・ Dv50:試料体積の50% が下回る最大粒径であり、体積単位のメディアン粒径とも 呼
ばれます(図 39)。
図 39. 粒度分布を表す名称19)
2) ある治験薬の粉砕機の検討例
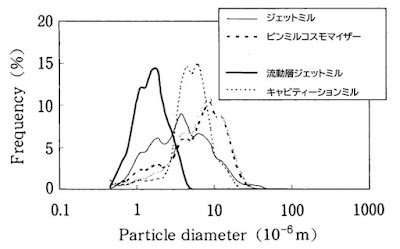
福中ら20)は原薬MK-J1の各種粉砕機での粉砕後の粒度分布を示している(図 40)。流
動層ジェットミルが最も小さいD50値とシャープな粒度分布を示しています。この様
に、粉砕機の原理の違いにより粒度分布を制御できるが、粉砕機への試料の投入速度
(投入量)、回転数或いは高圧ガス圧等を変化させ所望の粒子径・粒度分布が得られる
条件を検討する必要がある。
図 40. 治験原薬 MK-J1の粉砕機と粒度分布の関係20)
3) 各種粉砕機の特徴
医薬品原薬の粉砕に用いられる粉砕機、筆者がプロセス開発を行っていた時に使用した
経験のある粉砕機の 3 種類について少し記載する。詳細な説明、原理スケールアップに
ついて必要な方はメーカーの仕様書、メーカーに直接或いはweb上で検索されたい。
(1) ジェットミル
数気圧以上の圧搾空気、または高圧蒸気、高圧ガスを噴射ノズルより噴出させ、このジ
ェト気流によって原料粒子を加速し、加速された粒子どうしの衝突または加速された粒
子との衝突作用や衝撃作用、および摩砕によって粉砕します。
図 41. カウンタージェットミルの構造と原理21)
(2) 高速回転粉砕機(ハンマーミル)
ハンマーミルは高速回転するハンマーによって供給粒子に衝撃を加え粉砕します。ハン
マーはスウィングハンマータイプであり、出口側に多孔板やスクリーン、グリットなど
をおいて、スクリーンミルとして粉砕製品の粒度のコントロールを行うことが出来ま
す。
図 42. ハンマーミルの内部構造22)
22) 増幸産業株式会社より
(3) 高速回転粉砕機(ピンミル)
向かい合った2枚の円板の表面に数十本ないしそれ以上のピンを互いにかみ合うように
植え、片方の円板あるいは両方の円板を高速で回転させて砕料を円板中心に供給し、遠
心力で円周方向に移動する間にピンによる衝撃力、せん断力によって粉砕を行います。
供給量が少ないと多くの場合、粒子径が大きくなることがあります。これは、供給量が
少ないと、機内の粒子の存在率が低くなるため、十分な衝突もないまま粒子がピン円盤
内を通過してしまい、逆に、供給量が多いと粒子1個当たりのピンディスクとの衝突回
数が減少するためと考えられる。
(4) ピンミル粉砕機のスケールアップ時の問題点 1
粉砕機のスケールアップは粉砕原理を(機種)変えてはいけない。同じ粉砕機を用いて
時間を掛け数回に分け実施するか、大型機を用いる場合は一からデータ取りが必要とな
る。ピンミルの場合はピンの数、ピンとピンの間隔、回転数並びに投入速度により粒度
分布が異なって来ることから、粉砕機を大型化した場合は、その粉砕機で粒子径、粒度
分布を合わせるために全ての操作条件のデータ取りを行う必要がある。
上記でも述べたが、ピンミルの原理は、図 43 で示す様に、試料を上部のホッパ (A) か
ら振動フィーダにより定量供給され、ドア側に固定されたピンディスク円盤 (B) と回転
する本体側のピンディスク (C) の中心部へと試料が供給され、中心に供給された試料が
遠心力で円周方向に移動(分散)する間にピンによる衝撃力、せん断力によって粉砕さ
れ排出口 (D) より排出される。ピンミルで得られる粉砕サイズはディスクの回転速度、
ピンの数、ピン間の間隔、原料の供給速度の変更により調節することが出来る。この様
に、粉砕粒子が衝突、擦れ合うため発熱が起こり、溶融してピンに固着することにより
摩擦が増大し発熱する。このことから、スケールアップ時は、ピンディスクが高速回転
するために熱が発生し粉砕結晶が溶融してピン間に付着・閉塞(メルトバック)するこ
とがあり、連続して粉砕するとメルトバックが増大してピンが固着する可能性があるの
で気を付ける必要がある。
図 43. ピンミルの構造24)






























































コメント
コメントを投稿