医薬品原薬のプロセス開発に於ける晶析操作での結晶粒子径の制御
目次
初めに
1. 晶析に於ける結晶サイズの制御
2. 製造現場での原薬の精製(晶析)工程の操作の流れ
3. 晶析操作、溶解から結晶熟成までの冷却制御パターンと速度
3-1. 過飽和度と粒子径
3-2. 過飽和度と結晶粒子径(粒度分布の関係)
3-3. 種結晶(種晶)誘導の有無と結晶粒子径
3-4. 撹拌速度と結晶粒子径
3-5. 核形成温度と結晶粒子径
3-6. 冷却速度と結晶粒子径
4. 晶析操作の実験室でのデータ取り
5. 附則. 結晶粒子径を表す用語
初めに
医薬品原薬の晶析操作は、一気に大量の目的物(原薬・中間体等)を精製・結晶化させる操作で あり、結晶の純度、不純物量、不純物プロファイル、結晶多形、結晶癖、粒子径(粒度分布)とろ過性等の品質を決定する重要工程である。その中で、原薬の結晶粒度分布(粒子径)は、結晶多形と同様に、溶解速度と体内吸収(BA)に影響を与える重要な役割を担っている。粒子径が小さな原薬は結晶の比表面積が大きくなるため溶解速度が速くなり体内へ速やかに吸収されるが、結晶径が大きい原薬は比表面積が小さくなるため溶解速度が遅くなり体内吸収が非常に緩やかになる。原薬の溶解速度が異なると体内吸収に差が生じ薬の効き目が悪い、薬効が遅れて現れる、或いは最悪の場合薬効発現に必要な血中濃度に達せず薬効を示さない、或いは溶解速度が速すぎて副作用が出る等の可能性が出て来る。この様に、原薬の溶解速度・溶解度に関わる体内吸収は結晶粒子径(粒度分布、D50(メディアン径))並びに結晶多形により影響を受ける(図 1)。従って、医薬品原薬の粒子径サイズの制御(粒度分布の均質性)は医薬品の効き目に関わっており、新薬では、溶解性が問題となり治験薬の開発を左右することがある。後発医薬品(ジェネリック)では、新薬との生物学的同等性(血中濃度-時間曲線、溶出試験)が要求される。医薬品として求められる原薬は、シャープな粒度分布と適切な粒度分布(平均径)を持った結晶です。また、結晶平均径が通常より小さい、或いは粒度分布が幅広く微細な結晶多く含むと、ろ過性は悪くなり、ろ過時間の延長・結晶洗浄操作が不完全となり原薬・中間体の品質が悪くなる可能性がある。
図 1. アセトアミノフェン原薬の結晶
関口らは1)、Phenacetin を分級した粒子径の違うサンプルによる溶解速度差を図 2 に示している。この差は、粒子径による比表面積の違いであり、粒子径が小さい(a)
28-35 mesh 91.8 mg)と比表面積が大きくなり溶解液との接触面積が大きくなり溶解する速度が速くなるため、一般的に体内へ速やかに吸収される。また、藤田らは2)、グリセオフルビン製剤の溶出と吸収に於いて、粒子径を小さくすることが溶解速度を増大させ,吸収速度の増大にも影響をおよぼすものと推論していると述べている。
1) 関口慶二ら、薬学雑誌, 95(2), 195-203 (1975)
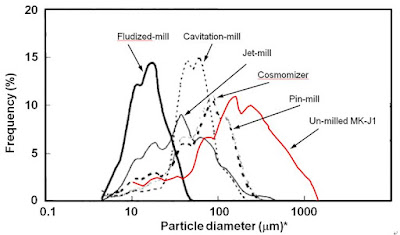
福中らは2)、開発中の原薬(MK-J1)が難溶性であるため、溶解速度を改善することを目的に各種粉砕機を用いて投入速度(feed rate)、粉砕圧(grinding press)、ロータ回転数等を変更させ粉砕中の温度上昇、粉砕後の品質を確認しながら最適粉砕条件を検討している。その結果から、溶解速度が速く吸収速度が安定させられる粒子モード径が最も小さく、シャープな粒度分布(単峰性)を与える流動層ジェットミル(Fluidized jet-mill)を選択している(図 3)。また、その粒子径を揃える最も有効な方法は粉砕工程を入れることであるが、図 3 で示す様に、原薬の粒子径・粒度分布が各種粉砕機での粉砕後の粒度分布は、一部の粉砕機(分級装置を有している流動層ジェットミル及びCavitation-mill以外)を除いて粒子径は小さくなっているがほぼ粉砕前の粒度分布のパターンを反映している。このことからも、晶析工程で粒子径と粒度分布を制御することにより、最終原薬で所望される(この場合は、最も体内吸収されやすい)最適な粒子径及び粒度分布を得ることが容易になる。
図 3. 難溶性の開発原薬(MK-J1)を各種粉砕機による粉砕前後の結晶粒度分布
2) T. Fukunaka ,et al., J.Soc.Powder Technol.,Japan, 40, 655-663 (2003)
以上の様に、安定的に本来の薬効を発揮させるためには、医薬品原薬は体内吸収、製剤化のために物性に合わせた最適な平均粒子径・粒度分布に揃える必要がある。原薬の粒子径並びに粒度分布は、溶出速度と体内吸収に影響することからより安定的に薬効を発揮させるために重要な役割を担っており、晶析工程で制御することが望まれる。晶析工程で精製された原薬の結晶平均粒子径並びに粒度分布が制御できれば 1 回の粉砕操作で要求される平均粒子径、シャープな単峰性粒度分布を持った最終原薬を容易に得ることが出来るようになる。
1. 晶析に於ける結晶サイズの制御
晶析時の結晶サイズ(粒子径)制御については、急冷・強撹拌させると小さい結晶粒子径(サイズ)或いはオイルアウトし、徐冷・弱撹拌或いは撹拌しないと大きな結晶が得られることを、皆さんは、既に経験上知っていると思います。従って、晶析条件を適切に選択できれば、結晶粒子径(粒度分)は制御が可能になることを意味している。
製薬メーカーから原薬メーカーへ移った時、プロセス研究者がある原薬のかさ密度が規格に合わせられないと言ってきた。この原薬の現行の晶析条件では針状晶を与えるため、かさ密度を合わせるのに苦労していた。かさ密度を上げるために原薬の粒子径を大きくすれば解決することが分かっていたが、本ブログで紹介する晶析条件による粒度の制御方法についてはこの時知らなかった。本原薬では、晶析をスイング法を何回か繰り返し大きな針状晶結晶を得て撹拌で破砕することにした。この方法でかさ密度を合わせることが出来、この時は事なきを得た。ここで紹介する粒度の制御方法は、一般的な方法であり汎用性の高い方法であると考えている。
晶析工程(操作)で得られる結晶サイズ(粒子径)に影響を与える因子
晶析時の結晶粒子径に影響する操作因子(ファクター)は、1) 過飽和度、2) 核形成温度、3) 種晶添加の有無と添加温度、4) 冷却速度並、5) 撹拌速度、並びに6) 晶析(熟成)時間等が考えられる。その中でも、操作因子である 1)~5) は特に強い影響を与える。
1) 過飽和度:溶液相から結晶核の発生と成長に影響し、結晶の成長(粒子径)を制御する。
2) 核形成温度:自然核を発生させるためには、溶液をある温度に下げ臨界過飽和度に導く必
要がある。一次核の発生とそれに続く二次核の発生に繋がり結晶の成長(粒子径)を制御す
る。
3) 種晶添加の有無と添加温度:種晶の添加は、種晶自身が核の役目を果たして二次核の発生を抑制する。また、添加温度は、加える種晶が溶解せず、成長もしないでバラバラにする必要があり、結晶の成長(粒子径)を制御する。
4) 撹拌速度:撹拌速度は物理的刺激となり、過飽和溶液から核発生数と結晶径を制御する。
5) 冷却速度:冷却速度は、核発生数と結晶核の成長(粒子径)に影響を与える。
6) 晶析(熟成)時間:熟成時間は、過飽和溶液から最大晶析率を得るために重要であるが、熟成時間が長いと成長した結晶同士或いは撹拌翼と衝突による破砕が増加し、結晶が小さくなる。
2. 製造現場での原薬の精製(晶析)工程の操作の流れ
医薬品原薬の晶析(再結晶)工程の操作には、一般的に冷却晶析、濃縮晶析及び貧溶媒添加晶析等が用いられることが多い。その中で、貧溶媒添加晶析については余り良い印象を持っていないのでここでは割愛するが、スケールアップ(製造)時に冷却晶析が最もよく用いられていると思っている。これらの晶析法は、何れも溶解(晶析)液を冷却、貧溶媒或いは濃縮等により適切な過飽和度に誘導させ結晶核を自然に発生させる、或いは種結晶(結晶核として)を強制的に添加することにより、結晶核を成長させる操作である。結晶粒子径を制御するためには、結晶核が発生する晶析液の過飽和度、冷却曲線、冷却速度及び撹拌速度(撹拌数)、或いは種晶添加時の条件(種晶の添加量、平均粒子径、温度、撹拌速度及び分散時間等の操作条件)を最適化させることが重要である。原薬の所望される平均粒子径を得るためには、粒子径に最も影響を与えるファクター(操作の条件)を見つけ出し、実験計画を立てデータ取りを実施することが重要である(図 4)。
図 4. 晶析工程の操作フロー
晶析工程の操作フローの中で、原薬・中間体の品質は核発生(或いは、種晶添加)と成長操作条件で決まる。その中で結晶粒子径の制御は核発生操作(条件)、冷却と撹拌速度でほぼ決定される。核発生時の条件が適切でなければ結晶粒度分布が幅広くなり、結晶子径が微細から大きなモノまで得られ、不純物を除去するろ過、結晶の洗浄操作が困難となる恐れがある。
3. 晶析操作での溶解から熟成までの冷却速度と制御パターン
原薬の純度、収率、不純物プロファイル及び結晶多形等の品質は使用する溶媒の種類と量の選定と冷却速度とプロファイル等の制御で管理出来ると考えられるが、結晶サイズ(結晶平均粒子径)の制御は冷却制御パターン、冷却及び撹拌速度、過飽和度、種晶の有無等の条件が重要パラメータとなる(図 5)。結晶平均粒子径(サイズ)は、ろ過性、製剤化及び生体吸収(血中濃度)等に影響を与えるため、原薬の重要な品質でもある。
また、晶析工程のスケールアップでは、プロセス開発時に設定したパラメータを含む標準操作法の条件を製造現場の実機晶析槽で忠実に再現出来る性能・能力を有する設備・機器(晶析槽、ろ過機及び乾燥機)の選定も考える必要があり、最終原薬の平均粒子径を揃えるために粉砕工程が必要となり粉砕機の選定も重要である。
図 5. 冷却晶析時の冷却プログラム
結晶平均粒子径の制御方法は個々の原薬(化合物)の性質により異なるため、個々から一般的な制御方法についてお話ししたい。
3-1. 過飽和度と粒子径
一般的な晶析では、粗結晶を加熱等により溶解した溶液状態の安定領域から、冷却或いは貧溶媒の添加等により過飽和状態を作って結晶核の発生、成長、熟成させ単離する。この時、経験的に熱力学的に不安定な状態にあるにかかわらず直ぐに析出しない準安定状態を経て、臨海過飽和度を超えてくると分子が集合しクラスター、更に核が形成され、その核が成長して結晶となり析出される(図 6A)。この時、図 6Bに示す様に、発生した結晶核をゆっくり成長させると大きな結晶(Profile B)が、急冷(刺激)すると発生する結晶核が多数生成し数多くの小さな結晶(Profile A)が生成する。冷却晶析では、準安定領域で種晶を添加し結晶を成長させつつ準安定領域を維持しながら冷却することで結晶粒子径を制御させられると言われている。
自然核発生させる晶析では、臨界過飽和度を境にして結晶核が発生し、その一次核がそのまま成長するとし結晶粒径が揃った小さな結晶が多数析出し、一次核から二次核が発生すると結晶径がバラバラな大小の結晶が析出してくる。
図 6. A溶解度曲線 B結晶の成長
・臨界過飽和度は、溶液が曇りクラスターが発生し、核が生成・成長して新しい相(結晶化)が出現し始める過飽和度
・安定領域は、未飽和状態にあり、結晶化が起こらない領域
・準安定領域は、過飽和状態にあるが自然核化は起こらないが、種晶などの結晶が存在すると成長する領域
・不安定領域は、自然核化が連続して起こり、結晶の成長を制御することが困難な領域
過飽和度が小さい時、核発生の確率はほとんど 0 であり、ある過飽和度の値(臨界過飽和度)で急激に大きくなり漸近的に結晶核発生確率に近づき核が形成される。過飽和度が高い時ほど核の大きさは小さく、核数は大量となり、過飽和濃度と生成粒子の径とは反比例すると言われている3)。二次核の発生は、その発生速度が過飽和度に依存し、また、通常の工業装置で撹拌速度を上げれば二次核発生は激しくなると言われている。しかしながら、結晶析出にある誘導時間の存在するような低過飽和度(低濃度)では、粒子数は濃度(過飽和度)に関係なくほぼ一定となり、核数は増加せずに結晶成長が主として行なわれる。即ち、個々の結晶粒子径はその粒子の滞留時間すなわち成長時間に比例すると言われている。このことから、二次核の発生は核発生と結晶成長が同時に進行するためであり、二峰性、或いは幅広い粒度分布を与える4)。
二次核の発生が発生すると、大きな結晶に微細結晶が混在(或いは、全てが微細結晶)することとなり、ろ過の際にろ布の目詰まりを起こし、ろ過性が悪くなり、十分な脱水(溶媒)と結晶表面の洗浄が出来なくなり、品質に影響を与える。
久保田・土岐らは、二次核発生を装置内で 抑止する手法について操作論の観点から検討し、その結果、種晶を装置内にあらかじめ十分量添加することで種々の操作条件の影響に関わらず二次核発生が抑止される「シーディング効果」を見出している。
3) 植田、色材, 43, 612-621 (1970)、松岡、日本海水学会誌, 45(6),
345-352 (1991)
4) N. Doki, N. Kubota et al., J. Chem. Eng. Jpn., 35, 2002,1078-1082、久保田徳昭, 松岡正邦著, 分かり易い晶析操作, 分離技術会, 2003,pp.35-41 、久保田徳昭著, 分かり易いバッチ晶析, 分離技術会, 2010,pp.11-31
3-2. 過飽和度と粒度分布の関係
三上ら5)は、アスピリン(アセチルサリチル酸)を用いて温度依存溶解度差を利用した 30% エタノール(99.5%)-精製水溶液で実験し、晶析スタート温度とその時の晶析液濃度、並びに得られた結晶粒子径の関係を示している(図 7)。実験条件は Table 1に示している。過飽和度が小さい場合(過飽和度 6.2 g/L-solvent)は、平均粒子径 104±19 mm の単分散結晶を与えている。しかしながら、過飽和度が大きい場合(過飽和度 100 g/L-solvent)は、平均粒径 363±18 mm の分布幅の比較的広い多分散結晶を与えることを示している(Table 1、図 7)。
低い過飽和度の場合は、核発生が比較的短時間で終了し、連続的な核或いは二次核発生が少なく多分散化の影響が小さくなり生成する結晶粒子が種晶としての役割を果たすためと考えられる。このことから、分布幅の比較的狭い単分散結晶を与えている。過飽和度が高い場合は、供給される分子が多く核発生が比較的長時間続き,連続的な核発生に伴う二次核が発生し粒径分布の多分散化の影響を受けるためと考えられる
Influence of supersaturation on crystal size
distribution of salicylic acid crystals:(a) 3.1, (b) 7.4, (c) 20, (d) 33, (e) 50
g/500ml-solvent(ethanol composition 30 vol.(%)
5) T. Mikami, et al., 鶴岡工業高等専門学校研究紀要 第47号
3-3. 種結晶(種晶)誘導の有無と結晶粒子径
種晶の粒度と量、添加温度等
種晶を添加する晶析法では、晶析中に種晶が成長するため粉砕して種晶の粒度(平均粒径)を揃えて置く必要がある。大島6)は、原薬ではないが土岐らが7)カリミョウバンを用いた実験室スケールの装置(12.2 L)とパイロットスケールの晶析槽(600 L)の晶析に於いて種晶添加量と得られた結晶の粒度分布の結果について述べている(図 8)。実験室スケールでは、平均粒子径 315 mmの種晶を用い添加率が 0.051w/w と少ないと 2次核の発生が抑制できず微結晶含む二峰性の粒径分布を与えるが、種晶添加率が 0.25 w/w と多いと添加した種晶のみが成長したと考えられる単峰性の粒径分布を与えている。また、12 Lから 600 L へのスケールアップに於いても、上記の種晶添加量の条件下で撹拌数を変更することによりスケールアップ前後で差がなく、同等の単峰性の粒径分布を与えている。
図 8. 種晶添加量と粒度分布の関係
種晶添加率(=[種晶添加量]/[溶液から析出する結晶全量])
6) H.
Oshima, J. Soc. Powder Technol., Japan,
38, 251-259(2001)
7) N. Doki, et al., AICheE J., 45, 2527-2533 (1999)
伊藤らは8)、Tetrahydroxybenzophenone (THPB) のアセトン溶解液からの晶析(35→25℃)に於いて、種晶(粉砕)添加量と得られる結晶の粒度分布の関係を図9に示している。種晶添加量が 0.001 (少量)の場合は、結晶粒度分布は微結晶(成長した 2 次核)と粗結晶(成長した種晶)が混在する 2 峰性粒度分布を与えるが、一方、種晶添加量が0.1w/w(大量)の場合は、微結晶の部分が消滅し単峰化した粒度分布を与えている。また、種晶添加による温度上昇ピーク(結晶化熱)は、種晶添加量が 0.1の場合に添加量 0.001 w/w より速い時刻に現れている(図 10)。これは、種晶添加量 0.1 の場合、大量の種晶が一気に成長するため、溶液は低過飽和のまま推移し2次核発生が抑制され得られる結晶はほぼ単峰性の粒度分布になったと考えられる。添加量が 0.001 の場合は、結晶化熱が遅れて長い時間続いており種晶、一次核とそれ続く二次核が発生し成長するため多峰性の粒度分布を与えると考えられる。
図 9. 粒度分布に及ぼす種晶添加量の影響 図 10. 過飽和度の変化に対する種
晶添加量の影響
8) 伊藤ら、SCEJ 73rd Annual Meeting (Hamamatsu, 2008) Q 306より引用
カリミョウバン及びTetrahydroxybenzophenone (THPB)の種晶添加晶析に於いて、種晶添加量が多い時は単峰性の粒度分布を与え、少ないと二峰性の粒度分布を与える。この粒度分布の違いは、種晶の添加量が多く十分に分散されていれば大量の種晶が一気に成長するため、溶液は低過飽和のまま推移し2次核発生が抑制され得られる結晶はほぼ単峰性の粒度分布を与え、添加量が少ないと結晶化熱がゆっくり長時間続くため一次核とそれ続く二次核が発生し成長するため多峰性の粒度分布を与えると考えられる。
この時、晶析条件として問題となるのは、種結晶添加量、種結晶の粒度、種結晶添加温度、種添加時の温度保持及び撹拌時間の決定、撹拌速度並びに冷却速度(プログラムか、直線か)が必要となる。実験計画を作成し、データ取りが必要となる。種晶添加温度は結晶核が発生しない温度であり種晶が溶解しない温度を選択する必要がある。撹拌時間は種晶を添加した温度で添加種晶が完全分散に必要な時間となる。
種晶誘導による結晶サイズ制御のための晶析操作条件
・ 種晶の有無
・ 種晶の量の最適化
・ 種粒度の最適化
・ 種晶添加温度と過飽和度の最適化
・ 種晶添加後、撹拌速度、完全分散(添加結晶の単体化)時間
・ 晶析時の撹拌速度と冷却速度
冷却晶析で添加する種晶の最適量は、幾何学的相似形晶析槽を用いて数回のデータ取りと簡単な物質収支の計算から,シードチャート(結晶粒径vs.種晶濃度)等を作成することによって決定する。同様に、粒子径を制御するためには、種晶添加温度、分散時間、撹拌速度並びに冷却プロファイル(冷却速度)等も決定することになる。
3-4. 撹拌速度と結晶粒子径
結晶は、溶解液が冷却或いは濃縮等により過飽和状態に達すると溶液からクラスターが生まれ(晶析液が曇る状態)、核化形成が始まり、それに続く核成長と結晶化が促進され系外へ沈降して行く。結晶が成長する時、溶解液中の周りの分子を結晶格子中に取り込むことから、結晶を均一に成長させるためには適切な撹拌速度により溶液中溶け込んでいる分子を均一に分散させる必要がある。
撹拌速度が速い場合、過飽和状態となった時に撹拌刺激と分散により一機に一次核が発生しサイズの小さな結晶が析出し、撹拌(熟成)時間が長いと晶析率は向上するが結晶が砕かれ結晶サイズが小さくなる。撹拌速度が遅い場合は、過飽和状態での刺激が少ないため核発生が少なくゆっくり結晶が成長して大きな結晶を与える。
翼形状には、形成された核或いは微細結晶を均一に撹拌して、均一に結晶の成長を促させる必要があり、形状の選択は重要となる。このことから、一般的晶析槽の撹拌翼はより均一な循環流が得られるアンカー翼が用いられることが多い。
撹拌時間と翼形状では、析出した結晶が撹拌翼及び結晶同士の衝突で砕かれることから、撹拌速度、撹拌翼の形状と晶析時の結晶熟成等に関わる撹拌時間が問題となる。
矢沢らは9)、フォスミドマイシン(fosmidomycin)を用いて晶析時の撹拌翼の回転数と平均粒子径の関係について、図 11 に示している。その時の晶析条件を表 2 に示す。フォスミドマイシンの晶析は、5 L晶析槽、傾斜バトル翼を用いて撹拌翼の回転数(撹拌数)及び晶析液量を変化させて実施している。その結果、モード径(最も頻度が多い粒径)は撹拌数に反比例して小さくなる。また、Run 5はrun 4より晶析溶媒容量が多くなると単位容積当りに加わる撹拌動力が小さくなるため平均粒子径が若干大きくなっている。run 13 はrun 3 より撹拌時間を1時間延長させると析出した結晶と撹拌翼との間、結晶間で衝突による破砕と結晶同士が凝集を起こしブロードな粒子径を与えている。
図 11. フォスミドマイシン撹拌速度と結晶粒子径(粒度)分布
9) 矢沢久豊ら、 フォスミドマイシン精製晶析のスケールアップ, 化学工学論文集, 20(5), 604-609 (1994)
大小の晶析槽では、上記で示した様に、単位体積当たりの撹拌動力と平均粒子径の間に反比例の関係が成り立っている。実際、実機の幾何学的相似形装置の撹拌翼の回転数(撹拌速度)をそのまま実機に適用すると、実機の単位体積当たりの撹拌動力は馬鹿でかくなり(晶析槽の撹拌機の回転能力を超えている可能性がある)微細な結晶を与えることになる。晶析時のスケールアップでは、実機の幾何学的相似形装置を用いて、所望の結晶平均粒子径が得られる撹拌数を検証し、実機の晶析槽の撹拌翼の回転数を「単位体積当たりの撹拌動力一定」で計算する必要がある。また、晶析のスケールアップに於いて所望の結晶の平均粒子径を得るためには上記の結果からも容積率(仕込み率)を変更してはいけない(図 12)。
図12. 実機と幾何学相似形晶析装置の容積率一定
上ノ山らは10)、塩化カリウム飽和水溶液は溶解温度 43℃ から 0-90分間 -0.075℃/min で冷却し、更、90-190 分間、-0.2℃/min で18℃まで冷却速度とプログラムで晶析している。その結果、結晶粒子径は、図 13に示す様に、撹拌翼の形状の違いにより差を示している。その中でドラフトチューブ付傾斜バトル翼(DTB型)槽は最も綺麗な左右対称の放物線の結晶粒度分布を示している。医薬品原薬の晶析槽には、撹拌翼としてアンカー翼がよく用いられる。このアンカー翼はDTB型晶析槽(バトル翼)のフローパターンと同等の撹拌状態(循環流)を示していると言われている11)。
図 13. 撹拌翼と粒度分布
10) 上ノ山周ら、日本海水学会誌, 56(5),
350-356 (2002)
晶析槽のスケールアップに於いて、黒田らは12)、粒径を制御する弊社のスケールアップ則として「単位体積当りの攪拌所要動力」を指標にしているが、未だ完全な一致が得られていないと言っている。しかしながら、我々は、製造現場の晶析槽の設計図から設計製作した 1 L 幾何学的相似形晶析槽(ミニチュア機)用いて、「単位体積当たりの撹拌動力一定」、「冷却曲線(速度)の相似」させてスケールアップすることにより、パイロット及び実生産でほぼ予測通りの粒度分布を得ることに成功している。スケールアップは難しい。
12) 黒田弘文ら、SCEJ 39th Autumn Meeting (Sapporo, 2007), Z305
3-5. 核形成温度と結晶粒子径
晶析操作での冷却速度(急冷、徐冷)、冷却パターン、冷却操作の開始と終了温度、並びに結晶核形成(誘発)温度は結晶の粒子径を含む品質に影響を与える。
晶析時の冷却速度の急冷は、溶解液が一気に過飽和状態となり小さな核が多数発生するが、二次核が発生する前に結晶が成長し、結晶粒子径(サイズ)が小さく揃った結晶を与える。徐冷では、緩やかに過飽和状態となりゆっくり少数の一次核が発生し、後に二次核が発生と一次核の成長が同時に形成 し、結晶粒子径がバラバラで大きな結晶を与える場合がある(図 14)。粒子径を制御するためには、過飽和状態で如何に結晶核を発生させ成長させるかでその後の結晶の粒子径を支配することから、核形成温度を管理することが重要である。従って、発生する結晶核が少ないと結晶粒子径が大きく結晶数は少なくなり、発生する結晶核が多いと粒子径の小さく結晶数が多くなる(図 15)。
図 14. 晶析操作時間と結晶粒子径 図 15. 結晶核の発生状態と結晶粒子径13)
13) 小針昌則, 日揮技術ジャーナル , 2(2), (2011)
3-6. 冷却速度、冷却制御プログラムと結晶粒子径
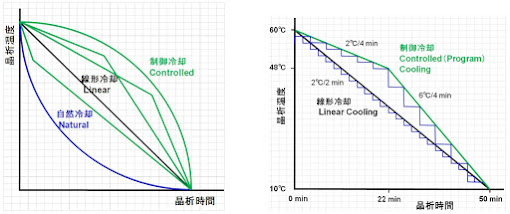
晶析に於ける冷却操作は、晶析操作で最も重要な結晶核を発生させるために溶液の過飽和状態を適切にコントロールさせることで撹拌速度と同様に結晶の成長を一定にすることが出来る。特に冷却制御プログラム(冷却曲線)は結晶の平均粒子径とその均一性並びにろ過性等に影響を与える。従って、晶析の冷却速度及び/或いは冷却曲線は結晶の粒子径を含む品質に影響を与える重要パラメータの一つである。プロセス開発では、晶析操作条件は製造現場での再現性と堅牢性を高め目標品質(純度、粒子径、粒度分布等)の結晶を得ることを目的として、冷却温度プログラムの制御が一般的に行われている(図 16A)。晶析初期は核生成が成長より支配的であり、リニアな冷却速度を晶析プロセスに適用すると核誘導時に過飽和度が大きくなり一気に核形成が起こるため粒子径制御が不能となる場合がある。結晶の粒子径を大きくするためには、晶析液の過飽和(濃度)度が高く結晶核量が少ない晶析初期は徐々に冷却し結晶核を成長させ、結晶量が増加して過飽和(濃度)度が減少してから冷却速度を速めるという制御冷却の手法がある(図 16B)。この手法は、晶析液の過飽和の制御と過剰な核生成との適切なバランスを取りながら二次核の発生を防ぐ方法として広く知られており、粒子径を制御させる優れた方法である。しかしながら、冷却速度の制御晶析は、その条件を確立するためには冷却曲線(冷却パターン)の多くの実験を必要とし、また、製造現場でノンリニアの冷却を実施することは難しくプロセスを複雑にさせる。但し、晶析冷却速度プロファイルが確立できれば、製造現場で核形成と成長を制御することが容易となり、安定して結晶粒子径を制御することが出来る。
図 16. 晶析冷却速度制御フロー(曲線)の概念図と冷却温度制御
冷却晶析で添加する種晶の最適量は、幾何学的相似形晶析槽を用いて数回のデータ取りと簡単な物質収支の計算から、シードチャート(結晶粒径vs.種晶濃度)等を作成することによって決定する。同様に、種晶添加温度、分散時間、撹拌速度、並びに冷却プロファイル(冷却速度)等も決定すべきである。
製造現場の温度制御が手動である場合は、段階的に温度を下げ冷却曲線に沿って制御することになるが、出来るだけ大きな温度変化を避け所望の冷却曲線に沿った降温操作が必要となる。例えば、「30分間で60℃ から 10℃ まで冷却する」と標準操作法で指図するのでなく、「5 分間で約 8℃ 冷却し 30 分間で 10℃ まで冷却する」等の工夫を行い指図すべきである。
4. 晶析操作の実験室でのデータ取り
晶析工程は製造工程の中で最終工程(或いは、粉砕工程の前工程)であり原薬の品質を決定するため重要工程であるため、PMDAは製造承認申請或いは MF 申請で工程管理をより厳しくする重要工程に指定する様に要求する。晶析工程の各操作は品質に重大な影響(クリティカル)を与える操作・条件の設定とデータ取りが重要となる。晶析実験は、各ステップ(実験・パイロット実験・実証段階)でデータ取りとデータの取り扱いが異なってくる。実験室では晶析条件である各操作のパラメータの設定、パイロッスケールでは実験室で最適化したパラメータで運転できるか、パラメータが機能し実験室と同等の品質が得られるかを検証し、製造ではパイロットスケール時に得られた結果から修正した各操作のパラメータが反映出来、機能し実験室と同等の品質の原薬が得られるかを検証する。そのためには、目的とする品質項目を保証(今回では、粒度分布と平均粒子径の制御)出来る原薬を得るために、各ステップでどの様なデータを取得すればよいかを考える必要がある(図 17)。
図 17. 晶析操作でのデータ取り
・晶析操作に於ける結晶平均粒子径・粒度分布制御に係わる品質リスクアセスメント
晶析工程に於いて、医薬品原薬の品質に係る結晶平均粒子径・粒度分布は、既に述べた様に、晶析時の核発生温度、結晶核の成長温度、種結晶の添加の有無・量、撹拌速度、冷却速度等により重要な影響を受ける。晶析工程の実験計画、晶析法の開発、操作クリティカルファクターの検出とそれらのパラメータの設定等が必要となる。品質リスクアセスメントの結果は、仕込み比率・撹拌・温度・種晶の性質が粒度分布に影響する可能性があり、ラボデータおよびパイロット試験より,結晶成長は晶析装置内のせん断(撹拌)の影響を受けやすい。他の単位操作(濾過,乾燥を含む)は粒度分布に影響しないと考えられる。
粒子径及び粒度分布に与える影響のリスクアセスメント実施し(表 3)、データ取りの実験計画を行い(表 4)、クリティカルファクターを見出し操作実施範囲で管理することをお勧めする(表 5)。
所望の平均粒子径と粒度分布を得る晶析条件の最適化は、表 3 の品質リスクアセスメントの結果を基に実験計画を立て実験データ取りを取得する(表 4)。得られたデータは、品質への影響度を解析してクリティカルファクターがどの操作が、その管理範囲が狭いか等を考慮してクリティカルファクターを決定する。
表 4. 品質リスクアセスメントから最適化データ取りの実施計画(例)
所望の平均粒子径と粒度分布を得る最適化された晶析条件は、実験結果から得られたクリティカルパラメータの管理範囲を設定し、それを遵守する標準操作法の作成並びに製造記録書を作製し、製造での人為的逸脱を起こさないことを徹底する。また、クリティカルパラメータは、図 18 に示す様に、許容範囲に安全域を設け操作設定範囲で定める(表 5)。
表 5. 晶析(粒子径制御)に於けるクリティカルパラメータと管理範囲例
図 18. 操作パラメータの設定範囲の考え方
5. 結晶粒子径を表す用語
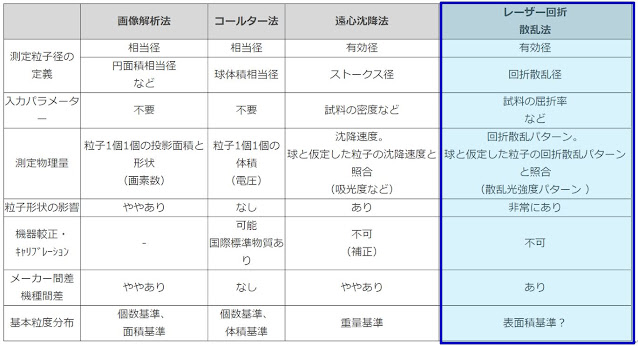
結晶の品質である結晶粒子径、粒度分布に用いられる用語について、お話しします。原薬のプロセス開発に従事するまで、粒子径(粒度分布)に関する用語、かさ密度(又はタップ密度)、安息角等について知らなかった。ここでは、プロセス開発者が最低知っておくべき結晶粒子径を表す用語について説明するが、粒度分布測定原理を表6 に示す。一般的に、製薬メーカー或いは原薬メーカーが有する粒度分布計はレーザ回折・散乱法による測定装置であり、この測定装置の利点は測定が簡便である点にある。しかしながら、結晶(粉体)は種々の形をした立体構造を有しており回折散乱パターンの処理方法により測定に差が出るのが現状である。従って、メーカー及び機種により粒子径の測定値に差が出るため、同じ結晶で測定し装置のメーカー間或いは機種間の差を理解しておかなければならない。但し、球形粒子の測定ではメーカー間並びに機種間の差はほとんど生じない。処理方法等は各メーカーで説明しているので参照されたい。
表6. 粒度分布測定原理-主な粒度分布測定原理-
製剤での原薬粒度評価項目
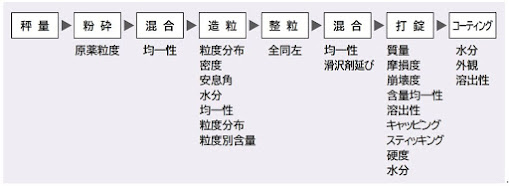
大阪府健康医療部薬務課から、固形製剤:整粒工程に於けるバリデーションの考え方と実施例【実施例編(付属書)】が発出されている。その中で製剤の均一性を確保するために、原薬の粒度評価項目として粒度分布、かさ密度(又はタップ密度)、安息角等が挙げられるが、一般的には粒度分布及びかさ密度が挙げられている。昔は、原薬の粒度等は製剤工程(図 19)に組み込まれていたが、現在では原薬の品質に組み込まれている。このことから、粒度分布は製剤メーカー(新薬及び後発品メーカー)の要求品質として原薬の品質規格に組み込まれることがある。
図19. 固形製剤の製造プロセスに関する製剤特性14)
14) 米持悦生、SCAS NEWS 2004-II, 3-6
粒度分布図の見方
現在、一般に粒度分布測定に用いられているレーザ回折式粒度分布測定装置は、レーザ回折・散乱法を原理とする粒度分布測定装置であり、粒度分布を体積基準で測定している。下図の粒度分布図は同一体積の粒子数の積算と累積体積を表している。
粒度分布図に於いて
D10:これ以下の粒子体積比率が10%である粒径、
D50:粒子体積の50%がこれより大きく、50%がこれより小さい粒径であり、メディアン径(中央径)とも呼ばれる。
レーザ回折・散乱法では、体積平均粒子径と呼ばれる場合がある。
D90:これ以下の粒子体積比率が90%である粒径を表している。
モード径:最も粒子体積の頻度の高い粒径を表している。
原薬の粒度分布は、溶解速度に影響し血中濃度にだが生じるため、重要な品質規格の項目となっている。粒度分布で問題となるのは、D50(メディアン径)とD90値、或いはD50 と単峰性で左右対称性に近い放物線での粒度分布を有しているかである。
図 20. 粒度分布体積標準表示図(横軸:対数スケール)
図 21. 積算図および頻度図における体積率*

*Malvern Instruments, 粒子特性評価のベーシックガイドより改変
最後に、
原薬の粒子径は製造工程で管理することになっている。医薬品原薬として必要な粒子径は晶析工程或いは粉砕工程で揃えることになるが、晶析工程で適切な粒子径の原薬が製造できれば粉砕工程で恒常的に品質に適合した粒子径の原薬を得ることが容易となる。
記載した「晶析操作での結晶粒子径の制御」は、晶析が専門家でない筆者が経験と専門家からお聞きした内容に、文献等から得た知識と医薬品原薬のプロセス開発でのデータ取りと製造現場での実証により得た晶析操作での粒子径の制御についてまとめたものです。内容は理解不足、間違った理解の所があるかもしれませが、筆者のボケ防止のためと経験を少しでもこれからの若いプロセス研究者の方々の参考になれば幸いです。理解できない或いは間違っていると思われた方は先輩並びに専門家の助言、或いは web 上で確認して頂きたい。






















コメント
コメントを投稿