医薬品原薬のプロセス開発に於ける晶析操作のスケールアップ
目次
初めに
1.原薬製造で用いられる精製方法
1)晶析(結晶化)
2)抽出法
3)液体カラムクロマトグラフィー法
4)蒸留法
5)撹拌洗浄・発汗法
2.医薬品原薬の最終(精製)工程の晶析
1)晶析工程をスケールアップ検討する実験機器・装置
2)晶析に際して重要な影響を与える因子
3)晶析操作条件の最適化
4)スケールアップ時の晶析操作及び設備の違い
3.晶析操作条件のスケールアップに関わる課題
1)スケールアップ時の検証項目とパラメータ数値の課題
2)晶析操作のパラメータ数値の取り扱い方の課題
3)生物学的(物理化学的)同等性の課題
4)製品品質規格
5)原薬の品質とコスト
6)冷却速度(勾配)5)原薬の品質とコスト
7)晶析槽の容量と伝熱面積
8)撹拌状態(流れ)の同等性再現
9)晶析槽の構造と性能・能力の理解
10)晶析槽の選択
11)撹拌と結晶サイズの制御
4.承認申請記載例から最終(精製)工程のプロセス開発に於ける晶析のスケールアップの進め方
1)平成17年3月23日 承認申請書記載例
2)品質リスクアセスメント
3)操作条件のデータ取りとパラメータ設定2)品質リスクアセスメント
5.結晶多形について
1)結晶多形とは
2)結晶多形の作り分け
6.結晶サイズと単峰性結晶粒子径分布の必要性
医薬品原薬のプロセス開発に於ける晶析のスケールアップ
初めに
ここからお話しする内容は、晶析化学、化学工学の素人である筆者が有機合成を専攻し医薬品原薬のプロセス開発時に携わった経験と文献或いは晶析化学の専門家から得た知識、製薬メーカー並びに原薬メーカーで複数の治験薬・新薬・後発品のプロセス開発に携わり5品目以上の医薬品を上市した経験からまとめたものである。著者は、製造工程の反応条件、反応メカニズム並びに工程操作の最適化がプロセス開発に於いて最も重要と考えているが、原薬の品質に重大な影響を与える重要中間体を精製する工程(精製工程)を入れることによりプロセス開発をもっと簡単にさせられるのではないかと考えている。
1. 晶析操作を製造現場で再現するために重要なこと
晶析のプロセス開発に於けるスケールアップに重要なことは、実験室での晶析条件の最適化と最適条件・操作を製造現場で忠実に再現することである。そのためには、最低下記に示す課題を最適化する必要がある。
1)
再結晶溶
a.熱時と冷却時の溶解度差
溶解時に最大溶解度が得られ、冷却時最小溶解度が得られる溶媒の選択すること。
b.精製効果
目的物を99.9%以上の純度を確保する晶析溶媒を選択すること。c.結晶多形
結晶多形は溶媒の持つ電気陰性度、双極子モーメント、水素結合能等の性質により作り分け出来るため、必要な溶媒を選択すること。
2)
冷却勾配
a.精製効果
冷却勾配は目的物の品質(純度、不純物プロファイル、結晶化度、結晶粒子径、結晶多形等)に影響するため、最適な冷却勾配を見出すこと。
b.制御冷却
自然冷却では晶析容量により冷却効果が異なってくるため、実験室の冷却勾配を現場で再現できない。品質規格に適合した原薬(目的物)等を恒常的に確保するためには、冷却勾配の制御が重要となる。このことから冷却勾配を最適化すること。但し、実験室の冷却勾配が製造現場の冷却性能、能力で再現できるかの確認すること。
c.結晶粒子径
冷却勾配は結晶粒子径の制御に重要な影響を与えるため、品質規格の結晶粒子径に合わせる冷却勾配を選択すること。
d.結晶多形
冷却勾配は過飽和度に影響を与え結晶多形制御に影響を及ぼすことから、目的物の結晶多形に合わせ冷却勾配を選択すること。
3)
撹拌状態
a.撹拌の均一性
撹拌の混合状態は結晶の成長に重要な役割を演じるため、晶析液が均一に撹拌できる撹拌速度とすること。
b.撹拌の同等性
撹拌状態がスケールアップ前後で異なると結晶粒子径を合わせることが困難となることから、撹拌状態を同等にすること。
4)
晶析率
a.目的物の品質
晶析率と品質は相反する場合が多いことから、最適な晶析溶媒の選択及び熟成温度と時間を最適化すること。
b.コスト
晶析率は製造量及び品質に影響を与えることから、製品のコストに影響するため最適な晶析率を選択すること。
c.熟成温度と時間
晶析率は熟成温度と熟成時間に左右されることから、最適熟成温度と時間を選択すること。
5) 熱安定性
a.熱安定性
目的物の熱安定性は品質(純度、不純物プロファイル、分解物)に影響するため、溶解温度での余裕のある安定性を確保出来る溶解温度と溶媒を選択すること。
6)
設備のスケールアップ
a.幾何学的相似形
晶析(懸濁)液の混合状態をスケールアップ後に再現するためには、幾何学的相似形実験装置(ミニチュア機)を用いること。
b.伝熱面積
伝熱面積(ジャケット表面積)は単位体積当たり2/3乗しか増加しないため、冷却勾配を再現出来るかを検証すること。
c.撹拌状態
撹拌(混合)状態はスケールアップ後も「単位体積当たりの撹拌動力一定」を保つこと。
d.仕込み率(容量)
スケールアップ前後の撹拌状態を再現するためは、実験晶析槽と同じ仕込み容積率とすること。
医薬品原薬のプロセス開発には、新薬開発と後発品開発の2つの考え方がある。
1)新薬開発の場合、治験薬開発時に時間とコストを掛けピカピカの原薬を製造するプロセス開発を行っても医薬品の開発スケジュールに間に合わない、治験薬開発時に有効性及び副作用等でのドロップアウト、或いは予測薬価から開発を断念せざる負えなくなる可能性がある。原薬工程の反応メカニズムの解明並びに製造法の最適化は勿論のことであるが、原薬の物性並びに不純物の物性に合わせた精製法を持つことが開発スピード、コスト及び純度の向上を達成できる場合があると考えている。医薬品原薬の製造量並びに最終品質は開発ステージにより異なることからそのステージに合わせて工程の反応条件の厳密化並び操作条件の最適化を実施されるべきである。プロセス開発時の治験薬を製造する方法及びコストを考えると、製造中間体に品質規格を定めた重要中間体を設定しその品質を向上させる精製工程(晶析・蒸留・カラムクロマトグラフィー等)を導入した方が有利に進められる場合もあると考えている。
2)後発品(ジェネリック)原薬の開発の場合、後発品メーカーは新規不純物を嫌うため、新薬に含まれる不純物プロファイルが同じであること、並びに全ての不純物量が少ない純度 >99.9%の原薬を要求する。後発品メーカーの品質要求を満足させるためには、後発品原薬の出発物質並びに重要中間体の選択とその品質規格の設定が重要となる。このことから、後発品原薬は新薬合成ルート(或は新規合成ルートの中で)の原薬により近い中間体を出発物質として選定されることが多い。最終工程の精製法には、残留溶媒の点から新薬と同じ晶析溶媒を用いて、新薬以上の高品質原薬を与える再結晶(晶析)法が求められる。出発物質並びに重要中間体の品質が原薬の品質を左右することから、出発物質の品質規格と重要中間体或は/及び原薬の精製法(工程)も非常に重要となる。
精製工程は、医薬品原薬のプロセス開発に於いて重要工程であり原薬品質(純度、不純物プロファイル、結晶多形、結晶粒子径等)を左右するため、原薬製造標準操作法の最終工程に必ず含まれる。一般的な医薬品製造の最終(精製)工程で使用する晶析設備・機器を示す。
図1. 原薬の最終工程(精製:再結晶)の操作の流れと使用設備機器
医薬品原薬(原薬)或は中間体のプロセス開発は、医薬品医療機器総合機構(PMDA)とのせめぎ合いであり、新薬或いは既存薬の承認申請(MF申請)に記載する製造工程の操作パラメータがどの様に設定されたかその根拠が問われる。このことからも、精製工程のプロセス開発は、品質マネージメントを通じてシステマティックに進められる必要がある。
本内容に筆者の思い込みによる間違い又は疑問等を持たれた方は文献・教科書等の専門書を参照されたい。また、マルチパーパス仕様の晶析槽とマニュアル操作での経験を記載しているものである。
*晶析とは、再結晶或は貧溶媒の添加及び濃縮等による結晶化を総称している。
2.原薬製造で用いられる精製方法
原薬或いは中間体の製造で用いられる精製方法には、1)晶析(再結晶法、再沈殿法等)法、2)抽出法、3)カラムクロマトグラフィー法、4)蒸留法、5)撹拌洗浄・発汗法、等がある。これらの中で、原薬の製造で最も多用される精製法は晶析(再結晶)である。
1) 晶析(結晶化)
晶析の原理は、表 1 に示す様に、冷却、濃縮品並びに溶媒の添加等で溶解度差を利用して過飽和状態を作り溶液中から目的物を系外(結晶化)に出させることである。一般的に、晶析は原薬製造の最終工程で用いられる。
表
1. 晶析の方法と原理
良溶媒:目的物を溶かす溶媒、貧溶媒:目的物を溶解困難な溶媒
再結晶法:医薬品製造では最終工程或いは中間体の精製法として一般的(大量精製可能)化合物を精製効果のある溶媒中で加熱溶解し、冷却することにより過飽和状態を作り結晶(原薬)を得る。温度或いは良溶媒と貧溶媒(2 溶媒で過飽和を作る)による溶解度差を利用する方法である。再結晶法には、回分式(バッチ式:一般的に医薬品の精製工程で用いられる)と連続式(大量精製可能)がある。
再沈殿法:化合物が溶解している溶液へ貧溶媒の添加、或いは pH の変更により溶解度を低減させ沈殿(結晶化)を繰り返して純度を高める手法である。原薬・中間体の精製に用いられるが、精製効果がない場が多い。
晶析のスケールアップは、スケールに合わせて全ての操作時間の延長とそれに伴う熱安定性の保証、撹拌状態(晶析液の流れ)の再現、並びに冷却速度(勾配)の維持等を確保することが重要となる。
操作時間:熱安定性が問題となるため、スケールに合わせて仕込み・加熱・冷却・ろ過等
の操作時間が増加する。
の操作時間が増加する。
撹拌状態:結晶粒子径(サイズ)に影響するため、スケールの増大に伴い撹拌状態(流
れ)を維持させるために撹拌翼の回転数を下げる必要がある。
操作温度:熱安定性が問題となるため、スケールに合わせて変更してはいけない。れ)を維持させるために撹拌翼の回転数を下げる必要がある。
2) 抽出法
抽出操作は反応の後処理として有機物と無機物の分離或いは酸及び塩基の分離に用いられる。抽出法は精製工程の前操作として用いられるのが一般的である。しかし、抽出法は大量処理可能であり、目的物或いは原料、不純物類、試薬等との分離にも非常に有効な手段となる。目的物と不純物類が極性物質である場合、それぞれの化合物の物性である pKa或いは溶媒への溶解度差等による差を利用することにより分離することは可能となる。図2に示す様に、反応混合物は水洗により無機塩等が水層へ、更に、含まれる化合物の pKaを基に水層のpH を調整、或いはキレート剤を用いることにより、不要物或いは目的物を水層或いは有機層へ移動させることが出来る。例えば、目的物と不純物の pKaが近い場合は、水層を化合物のそれぞれの pKa に合わせpHを段階的に調整することにより目的物を有機層或いは水層へ移動させ分離させることが出来る(図2a及び抽出例)。図2bには、ジオール体とカルシウムイオン(Ca2+)との錯体形成を利用した抽出法を示しており、錯体は水溶性となり水層へ移動させることが出来る。また、ピリジンは硫酸銅と錯体を形成する。しかしながら、抽出法は、晶析のような精度で精製はできないが、原料、試薬、副原料或いは不純物の物理化学的性質が近く再結晶法で精製できない時に試みる価値はある。
抽出のスケールアップは、バッチ(反応槽又は抽出槽)を大きくして行うだけであり、撹拌状態を合わせればスケール効果は小さい。
図2. 抽出法による精製
a.抽出精製の方法
抽出法の精製は水層pHの変更或いは抽出溶媒の物性を利用し目的の化合物或いは不要物を水層か有機層へ除去することにより達成させる。
b.事例、抽出法による化合物
A の単離1)
下記に示す混合物から化合物 A の単離は、水溶液のpHをそれぞれの化合物のpKa(類似化合物からの予測pKaも含む)に合わせて調整することにより実施した。有機層の抽出液を一部取りNMRで確認した結果、pH10.5からpH7.0へ段階的に変更することにより順次化合物A 以外は除去された。
1) 私的データより
事例 2、ジオール体の精製2)
l-メントールとジオール体との分離は、飽和塩化カルシウム水溶液と有機層(MeOH-n-Hexane(1 : 1))を用い抽出分離させた。有機層にはメントールが、水層にジオール体カルシウム錯体が抽出された。
2) 私的データより
3) 液体カラムクロマトグラフィー法
カラムクロマトグラフィー精製は、医薬品中間体或いは原薬が油状物質(高沸点オイル)、付加価値
の高く並びに熱不安定であり晶析等の他の方法での精製が困難な場合に非常に有用となるが、高
価な担体を用いるため高コストとなる。医薬品原薬の精製では、付加価値の高く(少量で高価)不安
定な化合物(プロスタグランン、抗生物質等)或は高分子化合物(ペプチド、タンパク質、抗体等)に
用いられている。
一般的に、カラムクロマトグラフィー精製は順相系ゲル(シリカ、アルミナ等)、逆相系ゲル(シリカゲ
ルの基材に C-18, Phenyl等の官能基を結合)、及びイオン交換樹脂等のゲル(担体)を後いて行わ
れる。クロマトグラフィーはそれぞれの担体と化合物の親和性を利用し、溶質溶媒の極性と脂溶性並
びに水溶性による溶出力の差により溶出の順番が決まる(図3)。そのためカラムクロマトグラフィーに
よる精製は被分離化合物の極性とゲルの選択とその量、均一な詰め方、溶出液の液性並びに均一
な溶出力が重要となる。
カラムクロマトグラフィーのスケールアップは、カラム担体量とカラムサイズ、カラムヘッドへの均一チ
ャージ及び均一な溶出液量が重要となる。図3 に示す様に、順相系と逆相系では溶出の順番が異
なる。一般的に、順相系では大量の試料を処理するために実験室のカラムの高さと直径を大きくして
スケールアップすることが多いが、逆相系カラムでは高さはあまり分離に影響を与えないため分析カ
ラムの高さを維持させ直径を大きくしてスケールアップさせる場合が多い。カラムクロマトグラフィーの
高さを高くすると成分の溶出バンドがブロードとなり、カラムの太さが太くなるとベット面積が大きくなり
隅々まで均一な溶出力を得ることが困難となる。カラムの中で均一に溶出できなくなると溶出バンド
が乱れ実験室で得られた分離性能が再現出来なくなる。
。
図 3. オープンガラスカラムと担体(順相・逆相ゲル)の性質による溶出順序とスケールアップ
4) 蒸留法
医薬品中間体或いは原薬の製造では、蒸留法は大量精製に向いているため時々用いられる。蒸留法は、目的物と不純物の沸点温度差を利用し、液体若しくは融点の低い結晶化合物を加熱して気体とし、気体を冷却凝集させ液体等に戻し目的物を得る(常圧蒸留・減圧蒸留)方法である。蒸留法で沸点の近い目的 物と不純物を分離するためには、加熱方法、精留塔の理論段数等が重要となる(図4)。
蒸留法のスケールアップは、全てのサイズをスケールアップさせる、或は精留塔の能力に合わせて蒸留スピードを管理し行う。
図 4. 実験室の蒸留装置
5) 撹拌洗浄・発汗法
撹拌洗浄・発汗操作は結晶を溶解させずに結晶の表面或いは内部に含まれる母液(不純物を含む)を除去する方法(大量精製可能)である。結晶表面に付着した不純物等は撹拌洗浄で除去することは出来るが、結晶中に含まれる不純物(母液)は洗浄できない。発汗は、目的物の融点近くの温度に加温することにより、結晶中に内封された液体不純物或いは母液等が付近の結晶を融解させ結晶欠陥或いは結晶集合体の隙間に沿って排出させる方法である。不純物を含んだ結晶Aは、発汗洗浄後結晶中に含まれた母液の不純物が結晶外へ排出される時、排出ルート(染み出した道)が空洞化し白化結晶Bの様になる。
図5. 発汗洗浄前後の結晶5)
5) 松岡正邦、結晶化工学、化学工学会監修より転写
医薬品原薬のプロセス開発を担う研究者は、原薬・中間体・原料並びに不純物の物性を知り、安価で効果的な精製方法を選択する必要がある。中間体・原薬製造に用いられる精製方法は晶析(再結晶)法、蒸留法、発汗法(中間体)、並びに抽出法(中間体)等が挙げられるが、原薬の最終工程では晶析(再結晶)が最も一般的に用いられる。精製方法の中で液体カラムクロマトグラフィーは、製造現場では大量のゲル及び溶出液を必要し、時間とコストを要するため大量製造に不向きである。但し、カラムクロマトグラフィーは高分子(ペプチド、タンパク質、抗体等)或いは不安定で付加価値の高い原薬・中間体の精製法として必須である。
2. 医薬品原薬の最終(精製)工程
原薬の最終工程はクリーンルーム(精製室)内で実施する精製操作であり、一般的に原薬の粗結晶
を製品品質規格に適合させるために再結晶(晶析)により行われる(図6)。
図 6. 最終晶析工程での粗原薬から原薬までの操作と設備機器例
この晶析操作のスケールアップに於いて重要なことは、反応工程と同様に実験室で最適化した操作
条件を現場の設備・機器で再現することである。そのためには、製造現場の晶析槽の幾何学的晶析
槽(ミニチュア機)を用いて実験室で晶析条件を最適化することである(図7)。
図7. 現場の晶析槽と実験機
その最適化操作条件である晶析溶媒、溶解濃度、溶解温度、種晶の有無、結晶化温度又は種晶
添加温度、撹拌状態(流体或いは懸濁液の流れ)、冷却速度(勾配)、熟成温度、仕込み容量/晶析
槽容量比、並びに全ての操作時間はスケールアップに際し変更してはいけない。但し、製造スケー
ルに合わせて粗結晶量、溶媒量、種晶の量、撹拌状態を合わせるための撹拌回転数は変更する。
しかしながら、スケールが上がると冷却並びに昇温に時間を要することから、熱冷媒温度等を調整す
ると共に、操作温度X延長操作時間に対する原薬の熱安定性確保を行う必要がある。実験室で晶
析のスケールに合わせて最適化された操作条件が製造現場(スケールアップ)で忠実に再現出来れ
ば、原薬が製品標準書(標準操作法を含む)に記載された製品品質規格(純度、融点、結晶粒子
径、結晶多形、不純物プロファイル及びその他製剤に必要な規格)並びに収率(結晶化率)で得ら
れる可能性が高くなる。
1) 晶析工程をスケールアップ検討する実験機器・装置
スケールアップは実験機で得た同じ流れの状態(撹拌)を現場の実機で実現することであるが、それを実現させるためには、①幾何学的相似、②力学的相似、③動力の相似を達成する必要があるとされている。しかしながら、撹拌状態(溶液・懸濁液の流れ)は幾何学的相似形装置を用いる限り、晶析槽の大きさが変わっても、単位体積当たりの動力を同じにすれば同じ効果が保たれる。
図 8 に、一般的に実験室で行われている晶析実験機器(方法a)を示したが、スケールアップをより効率的・正確に行うためには方法 bでのデータ取りが大切である。晶析の条件検討をより効率的(正確に、短時間で、低コストで)に行うためにパラレル合成機等を用いて一次データとして最適な溶媒(種類・量)並びに温度(溶解・結晶化・晶析率・熟成温度等)取りを行うことを薦める(図 8)。次に、製造で使用予定の実機のガラス製幾何学的相似形構造をしている1 L~2 L 程度の晶析槽(ミニチュア晶析槽)を用いて晶析条件の最適化を実施する。この時、製造スケールに合わせて使用予定の晶析槽の容積率に合わせ最適晶析条件を検証する(図8)。この様にして、実機へ適応する最適化晶析操作条件を検証し、標準操作法を確立する。また、この晶析標準操作法の検証は、現場の晶析操作に必要な幾何学的相似形晶析機、小型遠心分離機及び減圧乾燥機を用いてスケールダウンシミュレーションを実施することが一番の近道であると思っている。
図 8. 晶析操作の実験機器
2) 晶析に際して重要な影響を与える因子
晶析の各操作条件は原薬(結晶)の品質(純度、不純物プロファイル、結晶多形並びに結晶サイズ等)に影響を与え品質規格不適となる可能性があるため、スケールアップに耐える操作条件に最適化することが重要である。晶析操作条件(操作因子)が品質に影響を与える可能性を表2に示す。
表2. 晶析に影響を与える晶析操作因子とその影響
* 結晶化度:結晶部分と無定形結晶(アモルファス)部分の比率
実験室での晶析操作条件の最適化は、表2. で示した操作条件に与える影響を踏まえた品質リスクアセスメントの実施と製造現場の晶析槽及びユーティリティーの性能と能力を理解した上で行うべきである。
3) 晶析操作条件の最適化
実験室で製品品質規格に適合できる晶析条件は、溶媒の種類・量、晶析濃度、種晶の有無と量及び接種温度、撹拌状態(数)、溶解温度、冷却速度(勾配)、結晶化温度、熟成温度と各操作時間等の最適化を行う必要がある。そのためは、先ず、品質リスクアセスメントを実施する。その結果に合わせて検証項目のデータ取りを実施し、晶析条件を確立する(表 3)。品質リスクの危険度は原薬・中間体の性質、品質目標、設備等により異なるので、個々の化合物でアセスメントを実施し検証して頂きたい。
医薬品の製造工程のパラメータ等の設定はPMDAとのとのせめぎあいとなる。設定根拠が尋ねられる。
表3. ある医薬品原薬の晶析操作条件と品質リスクマネージメント及び検証項目の設定例
次に、晶析のスケールアップに合わせた操作条件(特に、操作時間及び撹拌状態)を予測し、その操作予測時間及び操作温度に安全率(操作時間は2倍以上、操作温度は±5℃程度)を掛けた熱安定性データを取得する。また、種晶の量と品質、撹拌数及び冷却勾配(速度)等に安全率を確保した幅で検証し、晶析の最適操作条件を設定する。設定した最適晶析操作条件がスケールアップ後の実機で忠実に再現出来るかどうかを、「(1) 晶析工程をスケールアップ検討する実験機器・装置」で示した様に、実機の幾何学的相似形晶析槽を用いてスケールダウンシミュレーションを行い検証する。この時、スケールに合わせた予測時間にプラスした時間並びに現場での操作手順に合わせて実施する。標準操作法がこの検証でバリデートされることにより、恒常的に製品品質規格(純度、不純物プロファイル、結晶多形、結晶粒子径及び製剤に必要なその他の規格)に適合した原薬が得られる。そのためには、図9 に示す様に晶析条件の最適化サイクルを回す必要がある。
図 9. 晶析条件の最適化に関わるリスクアセスメントのサイクル
図9の晶析条件の最適化サイクルを効果的に回すためには、品質リスクアセスメントとスケールダウンシミュレーションが非常に重要となる。 このことから、最適化された操作条件である ① 粗結晶の溶解温度、種晶の有無と種晶投入温度及び必要時間、② 結晶核発生(又は、種晶接種)温度、③ 撹拌状態及び冷却速度(冷却勾配)が製造現場の実機晶析槽設備で可能か、④ 実験室で熱安定性を担保した各操作が時間内(加熱、冷却及びろ過時間等)に終了するか、⑤ 製造スケールに合わせた操作条件を化学工学的計算(撹拌数、必要な冷媒温度等)或いは経験(計算できない場合)から予測し、スケールダウンシミュレーションで検証されるべきである。
この様にして得られた晶析最適化操作条件の妥当性は、その操作条件並びに操作手順下で晶析を最低3回連続で実施し得られる原薬が製品品質規格に適合していることを検証(バリデート)されるべきである。
4) スケールアップ時の晶析操作及び設備の違い
実験室での晶析操作データ取りは、反応工程と同様に現場の晶析槽の幾何学的晶析槽(ミニチュア機)を用いて実験室で晶析条件を最適化することであると述べたが、撹拌状態を同一にするためには重要である。しかしながら、幾何学的相似形(ミニチュア)晶析槽を用いた実験から得られた最適操作条件をそのままスケールアップしても現場実機で再現出来る条件と出来ない条件がある。現場晶析(スケールアップ)時に最低考慮すべき事項について述べる。
①
ミニチュア機と実機では、「晶析懸濁液の単位体積当たりの冷却面積」は同じではない。
②
ミニチュア機と実機晶析槽の「仕込み容積率(仕込み容量/晶析槽容量)」は、同じでなければならない。
③ ミニチュア機と実機晶析槽内の「単位面積当たりの撹拌動力(撹拌状態(流れ))は一定」でな
ければならない。
④
晶析の作業時間はスケールと共に増加するが、スケールが違っても結晶核発生(或いは、種晶の接種)温度から熟成温度までの時間(冷却速度(勾配))を同じでなければならない。
⑤
晶析操作時間並び熱・冷媒温度の違いは目的物(原薬)等の熱安定性に影響するため、操作時間の延 長と操作温度に安全係数を担保する必要がある。
以下に、①から⑤について解説する。①晶析(反応)槽の「単位体積当たりの伝熱(ジャケット部)面積」は晶析(反応)槽のスケールアップに於いて2/3 乗しか増加しない。このことから、冷却速度(勾配)が確保出来るかを検証しておく必要がある。伝熱面積の違いは、冷媒温度の変更を伴う場合があり、晶析液(母液 )とジャケット間の温度差が増大すると槽壁面で微粒子の結晶化が発生(これが結晶核となる場合がある)、スケーリング、結晶粒子径の微細化、品質の低下或いは結晶多形の析出が生ずることがある。また、結晶サイズの微細化はろ過時間の延長と晶析母液の抜けが悪くなり結晶(原薬)の品質に影響する恐れがある。②仕込み容積率の差は、撹拌された溶液の撹拌翼及びバッフルへの掛かり具合に差が生じ、スケールアップ後の撹拌数予測計算を困難にする。このことからも、ミニチュア機でのデータ取りは製造量に合わせた実機晶析槽の仕込み容積率に合わせて実施すべきである。また、仕込み容積率が異なると晶析槽内の冷却効果にも違いが生じ、結晶の品質(結晶サイズ、純度、不純物プロファイル等)に影響を与える可能性がある。③晶析槽内の晶析(懸濁)液の撹拌状態(流れ)は結晶サイズに影響することから、スケールアップ前後で同一にする必要がある。では、実機でどの様に再現するか、撹拌のスケールアップでもお話しした様に、晶析に於いても「単位体積当たりの撹拌動力(Pv)を一定」にすることである。撹拌状態(流れ)の違いは、結晶サイズの違いとして現れ、ろ過時間が異なってくる。ろ過時間の延長は原薬の熱安定性に影響を与え品質の劣化に繋がる可能性がある。④晶析で最も重要な結晶核発生(或いは、種晶添加)温度と冷却速度(勾配)は、原薬の純度・結晶サイズ等の品質に影響を与えることから、スケールに関係なく同じでなければならない。⑤各操作作業時間は仕込スケールに比例して増大する。作業時間が増加すると化合物(原薬)の熱安定性が問題となり原薬等の品質に影響を与える可能性がある。このことから、安定的にスケールアップ製造を実施するためには、製造スケールに合わせた予測操作時間並びに操作温度以上での目的物(原薬・中間体)の熱安定性を確保しておくことを薦める。
以上のことからも、恒常的に規格適合原薬を得るためには、製造スケールの晶析槽の構造・性能・能力を理解し、スケールアップ製造するまでに十分な操作方法・温度・時間等の設定根拠を固めておくことを薦める。更に、最適化された標準操作法は、製造スケールに合わせた操作条件(時間等)を用いて、ミニチュア機によるスケールダウンシミュレーションを実施し検証しておくべきである。
図10. 実験機(幾何学的相似形晶析槽)と実機(製造用晶析槽)の伝熱面積と容積率の違い
3. 晶析操作条件のスケールアップに関わる課題
1) スケールアップ時の検証項目とパラメータ数値の課題(表 4)
既に述べた様に、晶析ではスケールアップに伴い各操作時間の延長、撹拌数及びジャケットの熱冷
媒体温度の変更が必要となる。特に、操作時間の延長による原薬の熱安定性と冷却速度(勾配)の
保持が問題となる。熱安定性によるリスクを回避するためには、仕込み量に合わせた操作時間の予
測とその時間に安全率として最低2倍(操作状況により異なる)以上の延長した時間で、操作温度に
プラス5~10℃の熱安定性の担保を取得しておくことをお勧めする。原薬の熱安定性が確保出来て
いれば、製造現場の晶析操作に不都合が生じ中断しても品質を保証できる可能性が高くなる。
表4. スケールアップ時の検証項目
2) 晶析操作のパラメータ数値の取り扱い方の課題(表5)
晶析操作のパラメータには、スケールアップに際して変更する必要がある数値(示量的)と変更してはいけない数値(示強的)がある。この数値の取り扱いを間違ってはいけない(表5)。
表5. 晶析操作のパラメータ数値の取り扱い方
*スケールアップ時に変更する数値、 **スケールアップ時に変更してはいけない数値
3) 生物学的(物理化学的)同等性の課題(表 6)
医薬品原薬が恒常的に薬効(有効性)を保持するためには、原薬の生物学的同等性(血中濃度の同等性)が重要であり、体内への吸収が問題となる。原薬の体内吸収と血中濃度は原薬の溶解速度に支配され、溶解速度は原薬の物理化学的性質である結晶多形並びに結晶粒子径等によって決まる。原薬の体内溶解性を一定にさせるために、製品品質規格で物理化学的性質の項目として結晶多形及び結晶粒子径の規格が設定されている(表7)。その原薬の物理化学的性質は晶析条件である晶析溶媒と晶析濃度、種晶の品質、冷却勾配(速度)及び撹拌状態(流体の流れ)等により決まる。原薬の物理化学的性質である結晶多形・結晶粒子径は表6で示した試験方法で分析・区別することが出来る。
表6.
物理化学的性質の確認項目と試験方法
4) 製品品質規格(表 7)
製品(原薬)の安全性(毒性の担保)・薬効・安定性を担保するため、製品品質規格が決められている。品質規格は、プロセス開発・プラント製造等で作り込むのでなく、プロセス開発時に前臨床試験で担保した毒性(安全性)と有効性(薬効)から原薬の目標品質として決めるべきである。目標品質(製品品質規格)は、実験室で最適化した晶析操作条件である製品標準操作法に従い、実機(現場)晶析槽で忠実に再現することである。
表7. ある医薬品原薬の製品品質規格例
原薬に上記以外の光学異性体、遺伝毒性不純物等が含む場合は、製品品質規格書にその限度値等を定める。
5) 原薬の品質とコスト(表8)
原薬の品質は医薬品開発の成否に最も重要な因子であるが、また医薬品は商品であり原薬の製造コストも上市するために重要な因子でもある。一般的に、原薬の品質を上げるとコストは上昇する。原薬の晶析工程のコストは、晶析槽のバッチ仕込み効率(仕込み量と溶媒量:晶析濃度)、容積率並びに晶析率を最大にする必要である(表7)。
表8. コスト低減と課題
6) 冷却速度(勾配)
晶析操作は結晶原薬の純度を上げる、結晶(粒子)サイズを揃える、並びに結晶多形を揃える技術である。小さい結晶は溶解速度が速く、大きな結晶は遅いことから、結晶粒度分布は医薬品原薬の吸収と血中濃度(生物学的同等性)に影響する。従って、結晶サイズの均一性(単峰結晶粒度分布)を確保することは、原薬にとって非常に重要な品質項目の一つである。図11及び12に示す様に、結晶サイズを揃えるためには晶析液の冷却速度(勾配)と撹拌速度が重要な役目を果たす。冷却晶析では、緩やかな冷却とゆっくりした撹拌は大きな結晶を与え、急激な冷却並びに激しい撹拌は小さな結晶を、或いはオイルアウト(急激な過飽和状態)を引き起こす可能性がある。冷却勾配の違いは、結晶化の過程である結晶核発生状況と核成長に影響を与え結晶サイズ・品質に影響する(図11)。所望の結晶サイズを得るためには、冷却速度、撹拌状態、貧溶媒添加晶析では添加速度、並びに二次核の発生を抑えるために積極的な種晶の添加等により制御する必要がある。
図11.
晶析操作時間と結晶粒子径 図12. 結晶核発生状態と結晶粒子径*
7) 晶析槽の容量と伝熱面積
晶析槽内溶液の過熱・冷却時間は、ジャケットと伝熱面積(図 13)とジャケット内の冷媒温度によって決まる。幾何学的相似形間でのスケールアップでは、溶液量は槽内径の3乗で増加し、伝熱面積は2乗でしか増えないことから、晶析(反応)槽の「単位体積当たりの伝熱面積」はスケールアップに伴い2/3 乗にしか増えないと言われている(図13)。例えば、八光産業㈱の技術資料に従えば、500 L の晶析槽(反応槽)の伝熱面積は約2.8 m2であるが、2000 L へ容量が4倍スケールアップした晶析槽の伝熱面積は約11.2 m2(2.8 m2 X
4)でなく約6.8 m2(計算式では、42/3 X 2.79
=7.03m2)しかならない(表 9)。従って、大小の晶析槽で熱媒或いは冷媒温度が同じであれば、晶析槽のスケールが上がると加熱及び冷却時間が延長するようになる。温度管理が自動化された晶析槽ではプロムラミングすれば目標冷却速度(勾配)に合わせて冷却できる。マニュアル操作の現場では、晶析液(懸濁液)温度と冷却時間を確認しながらバルブ操作で冷媒を入れたり止めたりして冷却速度を管理することになる。このことから、伝熱面積の違いによる冷却速度(勾配)の管理は殆ど問題とならないことが多い。マニュアル制御をより容易にするために冷媒温度による目的温度への冷却(加熱)時間或いは冷却時間から必要な冷媒温度を予測するには、図14の「加熱・冷却時間計算式」と表 10の「総括伝熱係数(基本値)」を用いて温度制御(冷媒温度と冷却時間)を概算計算することが出来る。この様な計算をすることにより、スケールアップ時の冷却速度を一定にするために必要な概算冷媒温度を計算出来、現場製造時に計算値と実測による冷却速度の確認と冷媒温度或いは流量を微調整することでスケールアップ後の冷却勾配の制御を容易にすることが出来る。
但し、正確な伝熱計算(冷媒温度計算)するためには、使用する晶析槽の総括伝熱係数を測定する必要がある。
図13. 晶析槽の容量と伝熱面積
表9. 伝熱面積の計算表と実機の伝熱面積
6) 八光産業㈱の製品反応槽のデータより
図 14. 熱冷媒温度による加熱・冷却時間計算式(但し、冷媒出口温度差 t2<t1 ±5 ℃程度の場合に計算式は成り立つ)と加熱・冷却時間計算シート
(本計算シートは、製薬メーカーの化学工学の専門家に作成して頂いた)
(本計算シートは、製薬メーカーの化学工学の専門家に作成して頂いた)
加熱・冷却時間計算シート
冷媒 -10℃を用いて 80℃ から 5℃ へ冷却した場合、GL製 500 L(内容量 100 Kg) 晶析槽から2000 L(400 Kg) へスケールアップした時の概算冷却必要時間を計算した結果を示す。スケールアップにより1.66 倍の時間の延長が予測された。
表 10. 総括伝熱係数(基本値)7)
反応槽の基本的な総括伝熱係数 (U) (単位:Kcal/m2・hr・℃)。 但し、この値はあくまでも標準値(目
安)である。また、下記シートは
8) 撹拌状態(流れ)の同等性再現
晶析での撹拌状態は、冷却速度(勾配)と同様に、結晶粒子径のサイズに影響を与える。晶析時の急な(過激)な操作(撹拌、冷却)は結晶粒子径を小さくさせる。結晶粒子径が小さいとろ過が困難となりろ過時間に影響を与える。既に、「医薬品原薬のプロセス開発に於ける撹拌のスケールアップ」で述べた様に、大小の晶析槽で同じ流れを作るためには同じ川の流れるにある水車のように晶析槽のスケールに合わせ撹拌数を変換する必要がある(図 15)。大小の晶析槽で同じ流れにするためには、単位体積当たりの撹拌動力を一定にして撹拌のスケールアップを行う必要がある(図 15)。大小の晶析槽で槽内の流れを同じにするためには、「単位体積当たりの撹拌動力を一定」にして撹拌のスケールアップを行う必要がある。大小の晶析槽の撹拌状態の相似は、実機晶析槽である幾何学的相似形装置(ミニチュア機)並びに低粘度の溶媒を用い乱流域で運転する限り、レイノルズ数に関係なく撹拌数を変換することにより大小の装置の「単位体積当たりの撹拌動力(撹拌状態(流れ))を一定」にすることが出来る。
図15. 同じ流れにある大小の水車と大小の晶析槽(実験機と実機晶析槽)
大小の晶析槽内の晶析混合物(溶液若しくは懸濁液)の流れを合わせるためには、幾何学的相似形晶析槽の撹拌数を実機の撹拌翼径に合わせて計算予測する必要がある。この時、最適撹拌数のデータ取得は、予定製造量から実機晶析槽の仕込み率を計算し、幾何学的相似形(ミニチュア機)を用いて仕込み率を合わせたスケールダウンシミュレーションにより行う必要がある。
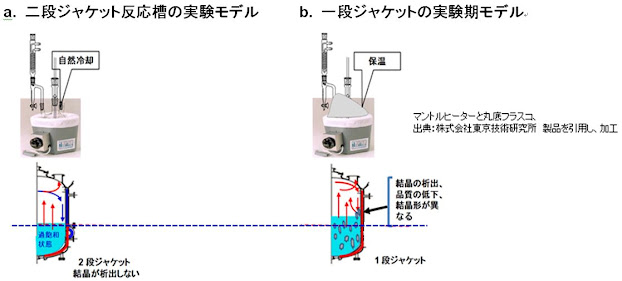
9) 晶析槽の構造と性能・能力の理解
晶析工程のプロセス開発を行っていた時、撹拌状態(数)と冷却速度(勾配)は幾何学的槽相似形晶析槽を用い化学工学計算と経験並びに操作時間の予測を行い、スケールダウンシミュレーションを実施し晶析条件を検証していた。しかしながら、濃縮晶析に置いて、実験室では図16 に示す様な丸底フラスコとマントルヒーター(ジャケット無しの状態)を用いて操作条件の最適化と濃縮晶析を 100%
成功させていたが。現場の実機晶析槽へのスケールアップ製造に於いて殆ど失敗していた。失敗は原薬が所望の溶媒和結晶でなく、結晶多形が得られ溶解度試験で品質規格不適となったためである。失敗の原因を探るため、実験室の装置と実機晶析槽(1段ジャケット)の違いを詳細に検討した。その結果、失敗するときは濃縮量が少ないこと、また図16a. で示す様にマントルヒーターから外に出ているフラスコ上部は自然冷却されており実機の晶析槽では2段ジャケットの役目をし、図16b. はフラスコの上部を保温したことにより1段ジャケットの晶析槽を模式していたと考えられた。実際、実験室でフラスコの上部を保温(図16b.)した時、濃縮により溶液濃度が上昇するとフラスコ壁と溶媒の界面上部のフラスコ壁の温度が高いため部分的に過過飽和となり界面の槽癖で結晶化が進み種晶を発生させていた。このことから、所望の結晶化条件が現場晶析槽で再現できず、結晶が実験室の濃度以下(図16a)で析出するためと考えられた。
図 16. 濃縮晶析時の実験装置と現場晶析槽の構造
この失敗は、実機晶析槽の構造と性能の違いを理解せず、実験装置での実験に疑問を持たずに繰り返し行っていたためであった。実際、現場の晶析槽を2段ジャケットにすることにより、本濃縮晶析は成功した。晶析(反応)槽の代表的なジャケットの構造を図17に示す。ジャケット構造は反応槽も晶析槽も共通であるため、理解しておくべきである。
図17 反応(晶析)槽のジャケット構造8)
10) 晶析槽の選択
既に述べた様に、晶析条件の中で撹拌状態(懸濁液の流れ)と冷却速度は重要なファクターであるが、晶析槽の構造、撹拌翼並びにバッフル(邪魔板)の構造もまた重要なファクターである。実機晶析槽には胴長槽と胴短槽があり、また、バッフル並びに撹拌翼の形状も様々である。このことから、使用予定の実機晶析槽の実機の性能・能力の理解とそれぞれの槽径等のサイズを合わせた幾何学的相似形実験機を用い仕込み容積率を合わせた晶析操作の最適化を行う(図18)。
図18 同じ容量のGL反応(晶析)槽でも違いがある(同容量の場合)
11) 撹拌と結晶サイズの制御
晶析槽に設置された撹拌翼及びバッフルの形状の違は、晶析懸濁液の撹拌状態(流体の流れ)の違いとして現れる(図19)。撹拌翼は、せん断力と吐出作用を有し、せん断力による結晶を切る作用と吐出作用による結晶衝突破砕を行う。従って、撹拌翼の形状は結晶サイズを制御するために重要な因子である。
このことから、晶析槽内の懸濁液の撹拌状態が均一であればある程、結晶の粒子径(サイズ)が均一になり易い。上ノ山*らは、傾斜バトル翼では3峰性を示すが、DTB型(晶析槽内にドラフトチューブを設置)晶析槽を用いると単峰性で正規分布に近い結晶粒子径分布を与えることを示している(図20)。 このDTB型と同様な流れを作る撹拌翼は、池袋琺瑯工業株式会社**に従えば、アンカー型撹拌翼が近い流れ状態を作り出す。医薬品原薬の最終精製(再結晶)工程に用いられる晶析槽の撹拌翼は一般的にアンカー型撹拌翼が多く用いられている(図19 )。
図19. 撹拌翼の違いによる晶析槽内の流体の流れ(撹拌状態)の模式8),9)
図20. 各種翼付晶析槽に於ける結晶粒子径分布9)
9) 槽内流体の流れ模式 上ノ山周ら、日本海水学会誌, 56(5), 350-356
(2002)
三上らは、晶析液の過飽和度が結晶粒子径とサイズのバラツキに影響を与えることを示し、過飽和度の増大と共に粒子径が増加傾向にあることを示した10)(図21)。
図21 過飽和度と結晶粒子径10)
10)三上貴司、鶴岡工業高等専門学校研究紀要 第47号
また、単峰性結晶粒子径を得るために晶析時の二次核の発生を抑制する工夫として種晶の大量の添加、並びに晶析槽の工夫等が行われているが、実際の原薬製造晶析で単峰性粒子径の結晶を得ることは非常に困難である。
4. 承認申請記載例から最終(精製)工程のプロセス開発に於ける晶析のスケールアップの進め方
1) 承認申請書記載例
下記の事例は、「平成17年3月23日 承認申請書記載例解説」に記載されている。また、ICHQ8, Q9, Q10で示されたQuality by Designで開発された原薬サクラミルの品質に関する概括資料である「サクラミル原薬 S2モック」も参照されたい。PMDAは承認申請書に記載されている標準操作法の操作条件であるパラメータの設定根拠を尋ねて来る。このことから、各操作条件の各パラメータの設定に関し、標準操作法のどの操作が原薬の品質にクリティカルなのか、どの様なデータ取りをするか、またどの様に根拠をもって設定したかが重要な課題となる。
Step 3 原薬
[4] の再結晶(晶析)工程(重要工程)
<標準晶析操作法*>
粗結晶 [4] 『16.0 kg』を“90%”注3)メタノール『(80 L)』注1)に加え,『60 ℃』に注2)加熱,攪拌して結晶を溶かす.活性炭を加え, 『60℃で 30 分』注2)攪拌する.固形物を加圧ろ過注4)して除き, 加熱した“90%”注3)メタノール『(5 L)』注1)で洗う.ろ液及び洗液を合わせ《30℃》注5) まで徐々に冷却して晶出させる.晶出した後,更に冷却し,《5℃》で 1 時間以上注5)攪拌する.析出した結晶を遠心分離注4)し、10℃以下に冷却した“90%”注3)メタノール『(10 L)』注1) で洗浄する.結晶を《40℃》注5)で減圧乾燥注4)し、1-[2’-(1H-テトラゾル-5-イル)ビフェニル-4-イル]メチル)-5-[(1E,3E
)-ペンタ-1,3-ジエン-1-イル)-1H-イミダゾール-2-イル]メタノール[4]を14.4kg得た後,粉砕(粒子径メジアン 10 mm以下注8))して最終原薬 [4] を13.7kg得る。
*届出事項『 』内に、一変事項《 》内に記載する。目標値/設定値以外の届出事項は“ ”内に記載する。
医薬品原薬の製造では、最終原薬の異物除去・不純物低減による純度を向上させ製品品質規格を満たすために最終工程に精製工程を必ず設定する。本工程は品質に重要な影響を与えるため重要工程とされている。承認書記載の内容だけでは、恒常的に品質規格に適合する原薬を得られない。このことから、製造標準操作法として製品標準書に詳細な製造方法を記載するが、操作条件に係る温度・時間・量・撹拌速度・圧力等の数値(パラメータ)には安全域を確保した範囲で設定することを薦める。但し、その各操作のパラメータの範囲中で最適値を目標値/管理値として設定しそれを確実にトレースする様に製造現場へ指導する。
2) 品質リスクアセスメント
恒常的な高品質の原薬を取得するためには、各操作並びにパラメータの品質リスクアセスメンを実施し標準操作法を最適化することである。そのためには、品質に重要な影響を与えるクリティカル操作並びにそのパラメータについて詳細なデータ取りとその設定が重要となる。晶析操作の最適化に必要な検討項目とデータ取得するための計画を作成する必要がある。例として、品質リスクアセスメントとして表11に、晶析最適化操作条件の検討項目とデータ取得計画を表12に記載した。但し、実際の危険度については異なる場合があるので参考としてほしい。
表11. 品質リスクアセスメント(例)
*危険度:品質に重大な影響を与える可能性。
表12. 晶析最適化操作条件の検討項目とデータ取得計画
3) 操作条件のデータ取りとパラメータ設定
晶析条件検討は、よりスピディーに、より低コストで実施するために、例えば、晶析溶媒であれば単一溶媒か、2溶媒系か、或いは使用量をどう決めるか、2溶媒系では比率をどうするか等の検討が必要となる。2溶媒系では、A /B = 90%, 80%,70%等々の比率で検討することになるが、得られた結果から品質(純度、不純物量と不純物プロファイル、結晶多形等)と収量より溶媒の最適比率を類推しその比率の近傍をより詳細に条件を検討し決定する。
(1)晶析(再結晶)溶媒
再結晶溶媒は一つ一つの溶媒を試すのではなく、例えば、図22 に示す様に、加熱できる試験管或いはガラスプレート*を用いて一時スクリーニング(再結晶溶媒と結晶多形) し、大まかな再結晶溶媒に当たりを付ける。次に、当たりを付けた再結晶溶媒を用いて、実際にナス型コルベンを並べるか、或いはケムステーション**の様な多連式反応装置で再結晶を行う。それらの再結晶溶媒の中で、得られる結晶(原薬等)の品質が規格(純度、不純物プロファイル、結晶多形、結晶サイズ並びに収率)に適合し、熱時溶解度が大きく及び熟成温度で最も溶解度が小さく、溶媒中での熱安定性に問題なく、並びに残留溶媒の可能性を考えクラス3の再結晶溶媒を選定する。更に、選定された再結晶溶媒を用い多連式反応装置等を用いて、晶析条件を効率よく検討する。
図22. ガラスマイクロプレートから製造現場へ晶析のスケールアップ
(2)晶析の仕込み濃度
仕込み濃度は製造効率(バッチ製造量)に影響を与え原薬等のコストに影響する。使用溶媒量を熱溶解度から出来るだけ最小量とし、基質(粗原薬等)の5~8倍の範囲で決める。
(3)晶析操作条件パラメータのデータ取り
データ取りは、先ず操作温度と時間経過による熱安定性データを取得し、操作温度許容範囲を検証する。一つの考え方として表13で示す様に、熱安定性では時間を倍々でデータ取得を実施する。例えば、純度が 96.0% 以下になると品質を確保できない場合、60℃での熱安定性試験の結果から溶解操作許容範囲は 3.5 時間以内となる。しかしながら、操作許容範囲がバリデートされていれば問題ないが、より安全に操作するためには操作許容時間に安全率(70%)を掛けるとすると操作時間は2.45時間以内となる。
表13. 例 晶析溶解温度60℃での時間経過と熱安定性
図23. 表12の結果を可視化(グラフ化):許容範囲 >96.0%、操作範囲
>98.0%
表13を図23に示す様にグラフ化にすると得られたデータが可視化(マンガ化)されデータの理解と説明が容易なる。
(4)晶析の冷却速度(勾配)
冷却勾配は、品質規格の純度、不純物プロファイル、結晶多形及び結晶粒子径等を適合した原薬等が得られるようなに設定されるべきである。例えば、手動による冷却操作の場合、標準操作法に冷却勾配の指図が「冷却開始温度60℃から60分で冷却停止温度0℃まで冷却する」と記載すると指図者が意図した黒矢印の冷却勾配を望んでも現場では赤矢印線 a或いはbの冷却速度(勾配)で冷却する可能性がある(図 24 A)。a及びbのどちらの冷却勾配でも製造管理上逸脱にはならないが、極端な冷却勾配(勾配)は原薬等の品質に影響を与える可能性がある。このことから、冷却勾配(カーブ)の目標として冷却速度を「5℃(温度)/5分(時間)」の様に決め、目標冷却勾配に沿った滑らかな勾配になる様に標準操作法に記載すべきである(図24B)。図24Bに階段状の冷却勾配を示しているが、図24Aより指図に近い滑らかなカーブとなる。実験室で最適化した冷却勾配を再現し易くなる。操作による逸脱が生じた場合は、原薬の品質を証明することは非常に困難である。何故なら、逸脱により生じる可能性のある新規不純物は構造が不明であり、既存の試験方法で評価出来るか不明であるためである。
図24. 冷却速度検討
(5)晶析時の撹拌数
撹拌数は幾何学的相似形晶析装置(撹拌翼、バッフル、晶析槽の全てのサイズ比が同じ)を用いて品質規格の結晶粒子径或いは安定性の点からろ過時間等から最適撹拌数を決定する。晶析のスケールアップに際しては、「撹拌状態(流れ)の同等性再現」で述べた様に、晶析槽体積と内容量の容積率を一定にして単位体積当たりの撹拌動力(Pv)を一定にして撹拌数のスケールアップを行う(図 25)。
図25. 幾何学的相似形晶析槽での撹拌状態のスケールアップ
(6)晶析操作パラメータの設定方法
この様に実験計画に沿って得られた晶析工程の操作パラメータ(許容範囲)は原薬の製品品質規格(品質目標)を保証するうえで重要である。しかしながら、恒常的に品質を確保するためは、図 26
に示す様に操作許容範囲に安全率を確保した操作範囲を設定し、その操作範囲内で製造標準操作法を作成する必要がある。次に、設定した全てのパラメータの操作範囲に操作条件の最適値を目標値として設定する。その目標値に従い可能な限り製造設備を運転することを製造現場に指図する。このようにして作成した標準操作法を用いて製造現場で晶析工程を検証する。晶析操作条件の中でクリティカルパラメータである操作温度と時間の熱安定性、冷却速度(勾配)と結晶粒子径、ろ過時間の予測と wet 率、乾燥温度と時間と熱安定性、晶析溶媒と結晶多形並びに残留溶媒等の検証を行う。
図26. パラメータ設定の考え方
承認申請書記載例解説の標準晶析操作法の場合のパラメータ設定例
晶析工程以外でも上記の「パラメータ設定の考え方」は用いることが出来る。仮に、操作温度が 80℃、操作に掛かる時間が 0.5
h である場合、安定かつ確実に操作するために原料・反応中間体・生成物等の熱安定性試験から操作温度は 80℃+5℃若しくは+10℃で最低 1.0 h 後の品質(安定性)を保証することを奨める(表14)。
表14. 例 操作温度 80℃での反応中間体の熱安定性の確認(溶解温度70℃、標準操作時間1.0h)
* 必要に応じて時間を延長して安定性のデータ取りを実施し品質(安定性)を保証する必要がある。
図27 表14の各温度での2 時間後の熱安定性 (%)
|
図27 で示す様に、原薬の99.9%以上の熱安定性を確保するためには、80℃で1時間以内操作する必要がある。75℃であれば2時間担保されているが、工程の不具合等で操作時間が延長すると操作温度70℃であれば2時間は担保されているが、75℃では2時間以上になれば純度 99.9% を確保できない可能性が高くなる。従って、逸脱、或は純度の低下を避けるためには、原薬等の熱安定性のデータ取りは出来るだけ時間を長くとり安全に、安定的に操作できる条件を確保することを推奨する。
以上の様に、工程操作を安全で安定的に並びに恒常的に遂行させ工程操作を保証し、製品品質を確保するためにはデータの取り方とそのデータの取り扱いが大切となる。工程操作の品質リスクマネージメントから重要操作を検証し、そのパラメータをデータ取得し、恒常的に原薬品質を保証するために範囲でのパラメータの設定と目標値を設定する。
5. 結晶多形について
日本製薬工業会に従えば、バイエル社によって開発されたアスピリン(アスピリンには、2つの結晶多形が存在する)は後発の他社のものよりよく効くという噂が流れたがその噂は事実であったと述べられている。同じ化学構造をもつアスピリンでありながら、バイエルのものは他社と結晶形が違っていた。そのため実際に、体内での吸収がよく、効き目も強く、胃への副作用も少ないことがわかった。たとえ化学構造が同じであっても、結晶多形によって、くすりとして大きな違いが生じることがわかり、結晶多形の重要性が認識されている。従って、原薬に結晶多形がある場合、承認申請書に医薬品原薬の結晶多形を記載することが求められている。結晶多形の特許は医薬品原薬の特許期間の延長により医薬品開発の戦略上重要である。
1) 結晶多形とは
一般的に、結晶多形は結晶の外観(形と色)が異なる場合が多い。しかしながら、図28 に示すセフマチレン塩酸塩水和物は結晶の形が異なるが、これらは結晶多形でなく結晶癖である。結晶は不純物等が結晶のある一辺に取り込まれるとその方向に成長し、分子の並び方が同じであっても外観が異なる結晶が出現することがある。これを「結晶癖」と呼ぶ。
図28. セフマチレン塩酸塩水和物の結晶癖11)
11)Yoshiyuki Masui, Organic Process Research & Development 7, 334-338 (2003)より転写
結晶多形は結晶の外観(形と色)、伝導性、溶解度、溶解速度、密度、融点並びに安定性等の違いとして現れるが、結晶多形を外観だけで判断することは危険である(図28)。溶媒中で加熱等により溶解した分子(溶質)は、溶媒との相互作用(溶媒和)により溶質の分子間相互作用及び分子の立体構造等を制御し、冷却等で過飽和状態になると制御された分子同士が凝集を始め結晶核が発生し、その核が成長して結晶となり溶液中に析出する。この時、これらの相互作用による分子の立体構造の違い或いは/及び分子の並び方(配列)等の違いとなり結晶多形として現れる(図29)。結晶中の分子配列(パキング)の違いは分子間相互作用(水素結合、p-p、或いはCH-p 相互作用等)、分子立体構造並びに原子間距離と角度等に影響を与え、結晶の物理化学的性質(外観、融点、IR・ラマンスペクトラム、DSC、固体NMR、粉末X線回析、単結晶X線構造解析、熱安定性、溶解速度及び溶解度等)の差として現れる。これが結晶多形である。原薬の場合、溶解速度と溶解度の違いは生体中の吸収速度と血中濃度の差を示し医薬品(原薬)の有効性の差として現れる。また、結晶多形は原薬の安定性に影響を与える。
図29. N-3,5-di-tert-buthylsalicylidene-3-carboxyanilineの結晶多形12)
12)上本紘平ら、1A04 ホトクロミック化合物サリチリデンアニリン誘導体の3つの多形結晶とその物性より転写
例えば、アスピリンには、2つの結晶多形が見出されている。それらの結晶多形は、図30に示す様に、アスピリン分子のパッキングの違いによりI形晶(form I)とII形晶(form II)に区別されている。ちなみに、医薬品のアスピリンはI形晶である。これらの多形は分子のパッキング、水素結合が異なっている(図30)。
図30. アスピリンの結晶多形の分子パッキング13)
13) 豊橋技科大工 小畑ら、結晶計算法によるアスピリン結晶の配座多形解析より引用
結晶多形の分子パッキング、分子間水素結合等の違いは、分子間の相互作用の強さとして現れ、同じ分子であっても結晶間で溶解速度・溶解度の差として現れる。例えば、図3114)はパルミチン酸クロラムフェニコールの結晶多形である
A形 (安定) 晶と
B形(準安定)晶を
0 から 100% まで 5段階で混合し懸濁シロップ剤を調製し、6名の健康人に投与して得られた血中濃度曲線である。最も高い平均血中濃度はB形晶のみの懸濁液で得られ、A形晶とB形晶ではその差が約 7倍であった。この結果は結晶多形の種類によって血中濃度が影響を受けることを示している14)。
図31. クロラムフェニコールパルミチン酸エステルの結晶多形比による血中濃度推移14)
14) 松田ら、粉体工学誌, 21(11), 704-714 (1984)より転写
A. J.Aguiar, et al., J.
Pharm . Sci., 56, 847 (1967)
クロラムフェニコールパルミチン酸エステルの A
形晶と B
形晶の混合比により経口投与した時の平均血中濃度差があることを示している。M : A/B=0%, N :
A/B=25%, O : A/B=50%, P : A/B=75%, L : A/B=100%
2) 結晶多形の作り分け
結晶多形の作り分けには、二つの方法がある。①冷却等による原薬の過飽和度差を利用して行う方法(オストワルドの段階則;図32)と②溶媒の性質(効果)を利用した相互作用により分子コンフォメーションを規定させる方法(表 14)がある。医薬品原薬の結晶多形の作り分けは、溶媒種類(性質の差)を利用した結晶多形の作り分けが一般的で簡便である。製造現場では、溶媒の効果(物理化学的性質;誘電率、プロトン性等)を利用する方が晶析操作をコントロールし易くなる。
① オストワルドの段階則に基づく結晶多形の作り分け
図31に示す様に、「オストワルドの段階則」に基づく結晶多形の作製コントロールは複雑となり、実験室の最適化条件をスケールアップした製造現場で忠実に再現する必要がある。
図32. オストワルドの段階則に基づく結晶多形の作り分け
再結晶(冷却晶析)では、結晶 Aは加熱することにより溶解し「溶液S」に移動する。次に冷却することにより溶解度が小さくなり「半溶解B 」に移動し結晶化が始まる。この地点が「a形晶の過溶解度曲線」の場合、不安定晶である a 形晶の核が形成され a 形晶が析出し始める。さらに冷却していくと「a 形晶溶解度曲線」を超え準安定領域に入り、「b 形晶過溶解度曲線」を超えると安定晶である b 形晶へ転移する。さらに冷却しても安定晶である b 形晶が析出してくる。不安定晶である a 形晶を得るためには、「a 形晶の過溶解度曲線」と「a形晶の溶解度曲線」の間で温度をコントロール(冷却速度を合わせる)する必要がある。
② 溶媒の性質(効果)を利用した溶媒和分子コンフォメーションによる結晶多形の作り分け
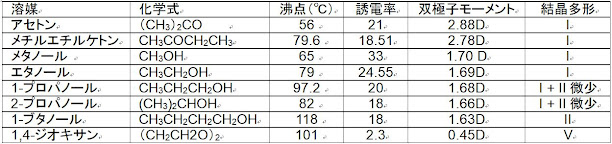
表15にフロセミドの溶媒種による結晶多形の作り分けを示したが、フロセミド分子はそれぞれの溶媒の性質に従い結晶多形を与える。非プロトン性極性溶媒のアセトン類であるアセトン及びメチルエチルケトン、並びに低級アルコール(メタノール及びエタノール)はI形晶(安定晶)を、C3アルコールである 2-プロパノール及び1-プロパノールでは微少のII形晶を含んだI形晶を、C4以上のアルコール類ではII形晶(準安定晶)を、1,4-ジオキサンはV形晶(不安定晶)をそれぞれ与える(表14)。このことは、アルコール類でも水溶性溶媒はI形晶を与え、脂溶性が上がっていくとII形晶を析出させる。また、表15で示す様に、プロセミドは双極モーメントが1.68Dを境にII形晶が析出し始め1.63以下では完全にII形晶のみとなる。分子は溶解した溶媒中で溶質-溶媒相互作用により立体が規制され、更に冷却等による過飽和状態になると溶質-溶媒相互作用と溶質-溶質相互作用の両作用により立体構造が規定され立体を保ったまま分子が凝集し結晶核を形成すると考えられる。
表15. 例、プロセミドの溶媒効果(種類)に基づく結晶多形の作り分け15)
15) Y. Matsuda, E.
Tatsumi, Int. J. Pharm., 60, 11 (1990)より引用
上記で使用された溶媒の誘電率、双極子モーメントと結晶多形16)
次に、大島らは17)、タルチレリンの結晶多形を溶媒の種類によって作り分けが達成できることを、
NMR(核磁気共鳴)を用いて示している。タルチレリンは重水中(D2O)でNOE(オーバーハウザー
効果)が観測されるが、ここにメタノール(CD3OD)を添加していくとNOEが観測されなくなる(図33)。
この溶媒効果は、実際の晶析で確認している(表16)。メタノール含量が30%を超えると種晶の多形
に関わらずb形晶を与え、10%以下のメタノール含量ではa形晶を与えることを示している。このこと
は、溶液中の分子コンフォメーションの状態を保ったまま結晶化することを示している。
図33. タルチレリンの結晶多形のX線構造解析17)
表16 析出する多形に及ぼす種晶の影響
17)大嶋 寛, J. Soc.Powder Technol., Japan, 38,
251-259 (2001)
景近らは、N-Phenylhydroxamic Acidが溶媒依存的に分子コンフォメーションを図34に示す様にスイ
ッチすることを、NMRを用いて観測しそのコンフォメーションを保ったまま結晶を与える18)ことを示し
ている。
図34. N-Phenylhydroxamic acid の溶媒依存的コンフォメーションのスイッチ18)
18) H. Kagechika, et al., Crystal
Growth & Design, 6 (9), 2007–2010 (2006)
溶媒は、それぞれ固有の誘電率及び双極子モーメント、また、水素結合作用を有しており、溶解している物質(溶質)との間で静電相互作用(双極子相互作用、水素結合、疎水性相互作用等)により溶媒和(溶質(物質)-溶媒相互作用)を形成させる。溶質分子との溶媒和は相互作用により溶媒和された溶質分子の安定なコンフォメーション(立体構造)を形成させると考えられる。更に、過飽和状態では、溶質は溶質-溶質相互作用の影響も受けた溶媒和分子コンフォーマーを維持したままファンデルワールス力により集合し溶媒和クラスターを形成し、更に凝集が進み結晶核が発生し結晶化が進む。結晶多形は溶媒の性質により形成される溶質(物質)-溶媒相互作用並びに過飽和状態での溶質-溶質相互作用により決定されると考えられる。表17に各種有機溶媒の物性を示す。
表17 各種有機溶媒の物性19)
6. 結晶サイズと単峰性結晶粒子径((粒度)分布の制御の必要性
医薬品原薬の結晶サイズ(結晶粒子径)と単峰性結晶粒子径分布は体内での溶解速度と体内 吸
収速度等の薬物体内動態に差が生じ、薬物(原薬)の有効性に影響を与る。原薬の規格で定められ
た結晶粒子径と均一な結晶粒子径(単峰性結晶粒度分布)は薬物の体内動態を安定させる。結晶
の粒子径(粒度)は図35に示す様に、均一な単峰性aでは安定した薬物動態を示すが、ブロードのb
では緩やかに吸収されることになる。結晶の粒子径及び結晶多形は製剤の品質に影響する。
図35. 結晶の粒度分布20)
一般的に原薬の結晶粒子径(粒度)分布は、製剤メーカーの要求に合わせるために粉砕工程(或いは操作)が用いられる(表18)。その規格は、「D90=〇〇mm以下」或いは「D50=〇〇mm、D90=△△mm以下」の粒子径が求められることが多い。特に最近、溶解性が悪いが活性の高い化合物(原薬)の治験薬の開発が行われることが多くなってきており、粉砕機の第一選択として溶解速度を高めるためにより微細な結晶を与えるジェットミルが用いられることが多くなってきている。
表18 原薬の結晶粒子径(粒度)が製剤に与える影響
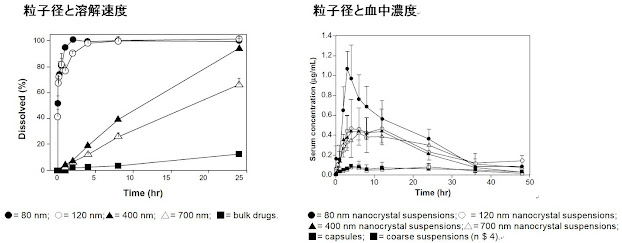
また、結晶粒子径は溶解速度と吸収速度に影響する。粒子径が小さいと吸収が速く薬物動態の最大血中濃度(Cmax)が速く増大し薬効が効きすぎる、或いは粒子径が大きいと逆に溶解速度が遅くなり有効血中濃度が確保できない可能性が出てくる(図36A)。更に、結晶粒子径の均一性(単峰粒子径分布)がない場合は、Cmaxの時間にズレが生じAUCが確保できたとしても有効血中濃度を確保できず薬物の薬効を保証できない等の現象が起こる。薬物の有効性を発現させるためには、結晶サイズと結晶粒子径分布が重要となる(図36B)。
図36. Coenzyme Q10の粒子径と溶解速度(0.6
mg/900 mL(蒸留水)並びに経口単回投与後の血中濃度(60 mg/body)21)
21) J. Sun, et al., International
Journal of Nanomedicine, 7, 5733–5744 (2012) より引用
以上のように、晶析のスケールアップには色々の課題を含んでいる。品質規格に適合する医薬品原薬を得るためには、品質リスクアセスメントを実施並びにクリティカルパラメータの選定とその検証計画の策定が重要となる。その検証計画に合わせ実験室でのデータ取りによる晶析操作の最適化、スケールに合わせた製造現場での操作方法、最適化したパラメータ及び時間等の予測とスケールダウンシミュレーションによる検証と必要に応じて操作条件の再最適化を実施する。パイロット製造或いは本番製造での失敗を最小限にするため、最大限の努力を実験室で行うことを薦める。
本内容が、これから晶析のプロセス開発を行う方々の参考になれば幸いである。


























































コメント
コメントを投稿